微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有3 mL甲烷和一氧化碳的混合气体,完全燃烧恰好用去3 mL氧气,则此混合气体中甲烷和一氧化碳的体积比是( )
A.1∶1
B.1∶2
C.2∶1
D.任意比
参考答案:B
本题解析:
试题分析:甲烷和CO的燃烧方程式分别为CH4+2O2=CO2+2H2O、2CO+O2=2CO2,设甲烷和CO的体积分别是x和y,则有x+y=3、2x+y/2=3,解得x=1,y=2,所以答案是B。
考点:物质的量计算
点评:本题非常简单,用十字交叉法计算更简单。
本题难度:一般
2、填空题 将24.4 gNaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为 。
(2)该溶液中NaOH的质量分数为 。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为 。
参考答案:(1)6.1 mol/L
(2)20%
(3)
本题解析:(1)24.4 gNaOH的物质的量为0.61 mol。
c(NaOH)=0.61 mol÷0.1 L=6.1 mol/L。
(2)100 mL NaOH溶液的质量为
100 mL×1.219 g/mL=121.9 g;
NaOH的质量分数为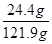 ×100%=20%。
×100%=20%。
(3)由于整个溶液都是均匀的,所以这10 mL溶液与原100 mL溶液相比,NaOH的质量分数和溶液的密度及物质的量浓度均相同,但NaOH的质量和物质的量均为原来的1/10。
(4)这10 mL溶液NaOH的物质的量浓度为6.1 mol/L,稀释到100 mL以后,NaOH的物质的量浓度缩小为6.1 mol/L÷10=0.61 mol/L。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.02 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.②③⑤⑥
B.①②③④⑤⑦
C.①③④⑤⑥
D.③④⑤⑥⑦
参考答案:A
本题解析:①错,12.4g白磷晶体的物质的量为0.1mol,而白磷的结构为空间正四面体形如图, 即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解;
即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解;
本题难度:困难
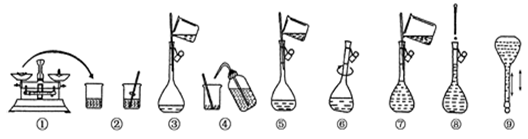
4、实验题 (12分)(实验题)下图为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。
回答下列问题:
(1)①中称得Na2CO3________g;选取容量瓶规格:______________
(2)容量瓶使用前检验漏水的方法是 ____________________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤________;
C.在第⑤步不慎有少量液体流到容量瓶外 ________。
D.未经冷却趁热将溶液注入容量瓶中定容 ________。
E.摇匀后发现液面低于刻度线再加水 _______
参考答案:(1) 5.3 250ml (每空2
本题解析:
试题分析:实验配制250 mL 0.2 mol/L Na2CO3溶液,需选用250ml的容量瓶,所配溶液需称取Na2CO3的质量为:0.2mol/L×0.25L×106g/mol=5.3g;选取容量瓶后需检漏,方法为:往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,则容量瓶可以使用;根据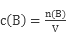 可知:定容时(步骤⑧)俯视会导致所配溶液体积V偏小,则会导致最终配置溶液的浓度偏高;没有进行洗涤转移(步骤④、⑤),则会导致n(B)减小故则会导致所配溶液浓度偏低;转移液体(步骤⑤)时液体溅出会导致n(B)减小故则会导致所配溶液浓度偏低;未经冷却趁热将溶液注入容量瓶中定容,溶液体积受热膨胀,会导致溶液体积V偏小,故所配溶液浓度偏高;摇匀后发现液面低于刻度线是因为再振荡摇匀的过程中,有一部分液体粘在了刻度线上方的器壁上,故无需补充水,所以加水后会导致所配溶液浓度偏低。
可知:定容时(步骤⑧)俯视会导致所配溶液体积V偏小,则会导致最终配置溶液的浓度偏高;没有进行洗涤转移(步骤④、⑤),则会导致n(B)减小故则会导致所配溶液浓度偏低;转移液体(步骤⑤)时液体溅出会导致n(B)减小故则会导致所配溶液浓度偏低;未经冷却趁热将溶液注入容量瓶中定容,溶液体积受热膨胀,会导致溶液体积V偏小,故所配溶液浓度偏高;摇匀后发现液面低于刻度线是因为再振荡摇匀的过程中,有一部分液体粘在了刻度线上方的器壁上,故无需补充水,所以加水后会导致所配溶液浓度偏低。
考点:一定物质的量浓度溶液的配制实验。
本题难度:一般
5、选择题 某KCl、MgCl2、Mg(NO3)2形成的混合液中,c(K+)=0.1mol/L,
c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为?????????????????? (????)
A.0.15mol/L
B.0.10mol/L
C.0.25mol/L
D.0.40mol/L
参考答案:D
本题解析:略
本题难度:简单