微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 C+CO2 2CO;ΔH1>0,反应速率v1,N2+3H2
2CO;ΔH1>0,反应速率v1,N2+3H2 2NH3;ΔH2<0,反应速率v2。如升温,v1和v2的变化是????????????????? (??? )
2NH3;ΔH2<0,反应速率v2。如升温,v1和v2的变化是????????????????? (??? )
A.同时增大
B.同时减少
C.v1增大,v2减少
D.v1减少,v2增大
参考答案:A
本题解析:考查外界条件对反应速率的影响。温度升高反应速率一定增大,而与反应是放热还是吸热无关,也与平衡怎么移动无关。答案A。
本题难度:简单
2、选择题 下列溶液与Fe反应制取H2的速率最快的是( )
A.20mL、1.0?mol?L-1盐酸
B.5mL、1.0?mol?L-1?H2SO4
C.10mL、18.4?mol?L-1?H2SO4
D.20mL、3.0?mol?L-1?HNO3
参考答案:A中c(H+)=1mol/L,而B中c(H+)=2mol/L
本题解析:
本题难度:一般
3、选择题 在一定温度下的容积不变的密闭容器中进行反应2X(g) 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
A.等于20s
B.等于18s
C.大于20s
D.大于 18s
参考答案:C
本题解析:
试题分析:由于随着反应的进行,反应物的浓度逐渐降低,所以反应速率逐渐降低,因此有 >
> ,解得t>20s,答案选
,解得t>20s,答案选
本题难度:简单
4、填空题 (14分)某化学反应2A(g) 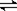 B(g)+D(s)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始为0。反应物A的浓度(mol·L?1)随反应时间(min)的变化情况如下表:
B(g)+D(s)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始为0。反应物A的浓度(mol·L?1)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟时间内平均速率υ(A)= 。
(2)在实验2中,A的初始浓度c 2= mol·L?1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且c 3= 。
(4)由本次实验,可推测该反应是 反应(选填吸热或放热)。理由是: 。
(5)1~4组实验中,A的平衡转化率最大的是第 组。
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为
(填>、=、<)0.125 mol·L?1;该反应的平衡常数K (填“不变”、“增大”或 “减小”)。
(7)若实验4起始充入2mol/L A,则达平衡后A的转化率与原平衡相比 (填“不变”、“增大”或“减小”)。
参考答案:(1)0.013 mol·L?1·min?1 &#
本题解析:(1)反应速率通常用单位时间内浓度的变化量来表示,在实验1中,反应在10至20分钟时间内A的浓度变化了0.80 mol·L?1-0.67 mol·L?1=0.13mol·L?1,所以其反应速率为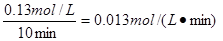 。
。
(2)实验1和2相比,平衡时A的浓度相同,说明其起始浓度是一样的,但和1相比,到达平衡的时间要少,即实验2反应快。因为平衡状态相同,而反应又是体积减小的可逆反应,所以只能是使用了催化剂。
(3)实验3在10至20分钟时间内A的浓度变化量是0.92mol·L?1-0.75 mol·L?1=0.17mol·L?1>0.13mol·L?1,实验实验3的反应速率快。
(4)实验1和实验4相比,A的起始浓度相同,但反应的温度不同,而平衡时实验4中的转化率高于实验1中的转化率,说明升高温度平衡正反应方向移动,因此是吸热反应。
(5)根据以上分析可知实验4的转化率最高。
(6)在实验2中,50 min时B的浓度是0.25 mol·L?1,将容器体积增大1倍,则B的浓度瞬间变为0.125 mol·L?1。因为降低压强平衡向逆反应方向移动,所以B的浓度会继续减小,到达新的平衡时要小于0.125 mol·L?1。平衡常数只与温度有关,所以改变压强平衡常数不变。
(7)因为反应物只有一种,所以增大反应物A的浓度,相当于增大体系的压强,平衡向体积减小的正反应方向移动,即转化率会增大。
本题难度:困难
5、选择题 决定化学反应速率的根本因素是[???? ]
A.温度和压强
B.反应物的浓度
C.参加反应的各物质的性质
D.催化剂的加入
参考答案:C
本题解析:
本题难度:简单