微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4A(g)+5B(s)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s)?????????B.v(A)= 0.030mol/(L ·s)?
C.v(C)=0.040mol/(L· s)?????????D.v(D)=0.090mol/(L· s)
参考答案:D
本题解析:
试题分析:在0.5L密闭容器中进行,30s内A减少了0.90mol,则用物质A表示的反应速率是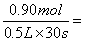 0.060mol/(L ·s),C不正确。又因为反应速率之比是相应的化学计量数之比,所以物质CD的反应速率分别是0.060mol/(L ·s)、0.090mol/(L· s),C不正确,D正确。物质B是固态,不
0.060mol/(L ·s),C不正确。又因为反应速率之比是相应的化学计量数之比,所以物质CD的反应速率分别是0.060mol/(L ·s)、0.090mol/(L· s),C不正确,D正确。物质B是固态,不
本题难度:简单
2、实验题 H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
(1)实验①和②的目的是_ ,
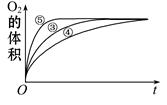
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
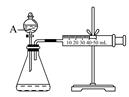
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
参考答案:(8分)(1)探究H2O2溶液的浓度的变化对分解速率的影响。
本题解析:
试题分析:(1)根据表中数据可知,实验①②中不同之处在于双氧水的浓度不同,所以实验目的是探究H2O2溶液的浓度的变化对分解速率的影响。
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,即实验结论是图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)要比较Fe3+和Cu2+对H2O2分解的催化效果,应在相同的条件下利用一个变量来比较,同时还需要测量测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是Fe2++2H2O2+4H+=Fe3++4H2O。
考点:考查影响化学反应速率因素的实验探究
点点评:该题是中等难度的试题,试题综合性强,侧重对学生实验探究能力的培养,有利于激发学生的学习积极性,也有助于培养学生的规范实验设计能力。所以该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题能较好的考查学生实验设计、数据处理、图象分析的综合能力。在解答时注意已知信息的利用。
本题难度:困难
3、填空题 反应 A+3B = 2C+3D在四种不同情况下的反应速率分别为:
①v
A.=0.015 mol (L·s) -1② v
B.=0.06 mol (L·s) -1
③v
C.=2.4 mol (L·min ) -1④ v
D.=0.045mol (L·s) -1
该反应进行的快慢顺序为?????????????????????????
参考答案:③=②>①=④
本题解析:依方程式系数比将各速率均置换为同一物质(例如A)的速率来表示,则各速率分别为①v (A)=0.015 mol (L·s) -1、② v (A)=0.02mol (L·s) -1、③v (A)="0.02mol" (L·s) -1④ v(D)=0.015mol (L·s) -1(一定要注意③单位与其它各速率的不同)
故该反应的快慢顺序为③=②>①=④
本题难度:简单
4、选择题 已知可逆反应:N2(g)+3H2(g)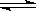 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是(???)???????????????????????????????????????????????????????????????? 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是(???)????????????????????????????????????????????????????????????????
A.加压可使该反应的反应速率变大
B.升高温度,该反应的正、逆反应速率均变大
C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ
D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
参考答案:C
本题解析:考查外界条件对反应速率和平衡对影响以及反应热的计算。反应有气体参加和生成,所以加压可以加快反应速率,A正确。升高温度一定加快反应速率,B正确。反应是可逆的,因此1mol氮气和3mol氢气不可能生成2mol氨气,所以放出的能量一定小于92kJ,C不正确。选项D中的反应速率方向是相反,且满足速率之比是相应的化学计量数之比,所以可以说明正逆反应速率相等,D正确。答案是C。
本题难度:一般
5、选择题 一定量的盐酸与过量的锌粉反应时,向盐酸中加入适量的下列物质,能减缓反应速率,但不影响生产H2的总量,适宜的方法组合为( )
①NaOH固体?②H2O③NaCl溶液④CH3COONa溶液⑤NaNO3溶液.
A.②③④⑤
B.②③④
C.全部
D.①②③④
参考答案:①NaOH与酸中和,引起H+离子的物质的量的减小,浓度减小,
本题解析:
本题难度:简单
|