微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工厂采用下列反应生产甲醇(CH3OH):? CO(g) + 2H2(g) 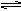 ?CH3OH(g) △H<0, 为了增加产量,提高效率,宜采用的反应条件是( )。
?CH3OH(g) △H<0, 为了增加产量,提高效率,宜采用的反应条件是( )。
A.高温、高压、催化剂
B.低温、低压、催化剂
C.适当的温度、高压、催化剂
D.低温、高压、催化剂
2、简答题 t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)
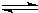
xc(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol?L-1.请计算:
(1)从反应开始到平衡状态,生成C的平均反应速率;
(2)x的值.
3、选择题 某温度下,反应2NO2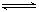 N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有
N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有
A.保持容器容积和温度不变,向容器内补充了NO2
B.保持容器压强和温度不变,向容器内补充了N2O4
C.保持容器容积和温度不变,向容器内补充了N2
D.保持容器的容积不变,升高了温度
4、填空题 A、B、C、D、E均为中学化学常见的10电子粒子。已知,M(A)>M(B),
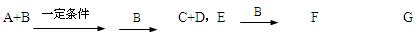
C是一种重要的化工原料。下图表示在1L的密闭容器中,一定条件下X、Y、C三种气体因发生反应而导致的物质的量随时间的变化情况。?

回答下列问题。????????????
(1)写出B的电子式????????????????????????。
(2)写出F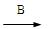 G的离子方程式?????????????????????????????。
G的离子方程式?????????????????????????????。
(3)根据题图写出相关的化学方程式??????????????????????????????。(用化学式表示)
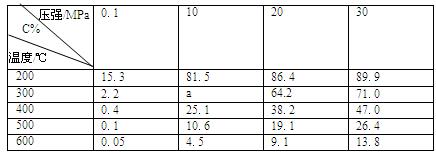
(4)下表为一定条件下平衡混合物中C的体积分数(C%)。分析数据可知,表中a的取值范围是????????????????????????????????????。??
 ?
?
(5)根据题图和题表分析,25 min ~ 40 min内曲线发生变化的原因可能是???????????(填选项代号,下同);50 min ~ 65 min曲线发生变化的原因可能是????????????。 ?
?
A.降低温度???????B.增加C的物质的量??????? C.加了催化剂??????D.缩小容器体积
(6)工业上合成C的温度一般选择在500℃左右,主要原因是??????????????????。
5、填空题 (10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=???????????????;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=???????????????;反应的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| ?
从上表可以推断:此反应是???????(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为????????。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有????????(填实验编号);
实验编号
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
| A
| 1
| 5
| 2
| 3
| B
| 2
| 2
| 1
| 1
| C
| 0.5
| 2
| 1
| 1
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是???????????。
①体系的压强不再发生变化?????????????????????????②混合气体的密度不变
③混合气体的平均相对分子质量不变???????????④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化?????????????????????????⑥v(CO2)正=v(H2O)逆
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种)??????????????????????????。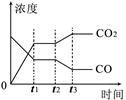
|
|