微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)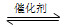 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
参考答案:D
本题解析:该反应中S为液态,反应前后气体的物质的量改变,在恒容容器中进行该反应,平衡前随着反应的进行压强一直在改变,A项错误;反应中S为液态,其量的变化不影响反应速率,B项错误;该反应的正反应是放热反应,升温后平衡逆向移动,SO2的转化率减小,C项错误;平衡常数只与温度有关,催化剂不能改变反应物的转化率,平衡常数不变,D项正确。
本题难度:一般
2、填空题 常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
?
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式?????????????????????????????????。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是______________________________________。
参考答案:(1)降低了活化能(2分)
(2)探究浓度对反应速率的
本题解析:
试题分析:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率。
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)。
(3)双氧水再催化剂的作用下分解生成氧气和水,反应的化学方程式为2H2O2
本题难度:一般
3、实验题 (9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
实验
编号
| KClO3
(g)
| 氧化物
| 产生气体(mL)
(已折算为标况)
| 耗时(s)
| 化学式
| 质量(g)
| 回收
| 1
| 0.6
| —
| —
| —
| 10
| 480
| 2
| 0.6
| MnO2
| 0.20
| 90%
| 67.2
| 36.5
| 3
| 0.6
| CuO
| 0.20
| 90%
| 67.2
| 79.5
| 4
| 0.6
| Fe2 O3 O3
| 0.20
| 90%
| 67.2
| 34.7
| 5
| 0.6
| Cr2O3
| 0.20
| 异常
| 67.2
| 188.3
|
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用?????检验。(填序号)
A、湿润的蓝色石蕊试纸?????????? B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸??????????????? D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、填空题 反应3Fe(s)+4H2O(g)

Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是______(填增大、不变、减小,以下相同).②将容器的体积缩小一半,其正反应速率______,逆反应速率______.③保持压强不变,充入N2使容器的体积增大,其正反应速率______.
参考答案:①因铁是固体,增加铁的量,并没有改变铁的浓度,所以不能改变反
本题解析:
本题难度:一般
5、选择题 在密闭容器中进行2SO2+O2? ??△??
.
?
?2SO3(g)(正反应放热).图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
A.减小SO2的浓度
B.降低体系温度
C.减小生成物的浓度
D.增大容器的体积

参考答案:A.减小SO2的浓度,平衡向逆反应方向移动,逆反应速率大于正
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772