微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)A、B、C是中学常见的三种非金属单质,常温下B为无色气体,A、C为固体,甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中,A、B、C与甲、乙、丙之间的转化关系如下图所示:

(1)写出C转化为丙的化学方程式________________________________________。
(2)常温下,按右图装配装置,待内外气体压强不变时,水银柱液面在M处,取下橡皮塞,在玻璃燃烧匙中加入乙,乙在B中充分燃烧,水银柱推向左管。
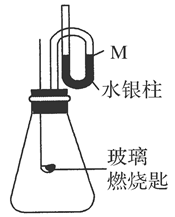
简要回答下列问题:
①写出乙燃烧的化学方程式:_____________________________________________。
②水银柱推向左管的原因是______________________________________________。
③火焰熄灭后,静置一段时间恢复到原温度,右管水银的位置应该是________。
A.仍在M处 B.高于M处 C.低于M处
做出选择后,简要说明理由_______________________________________________。
④用下图所示装置检验乙燃烧的产物A、B、C、D中所盛放的药品名称是:
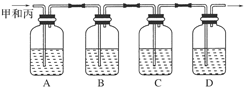
A.________ B.________ C.________ D.________
参考答案:(1)S+O2SO2??(2)①CS2+3O2CO2+2SO
本题解析:略
本题难度:一般
2、选择题 下列相关实验不能达到预期目的的是
[???? ]
相关实验?
预期目的
A.
相同温度下,等质量的大理石块、大理石粉
分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
B.
把装有颜色相同的NO2和N2O4混合气的两支
试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C.
在蔗糖中加入稀硫酸,水浴加热,再加入新
制的氢氧化铜并加热
探究蔗糖水解产物具有还原性
D.
两支试管中装有等体积、等浓度H2O2溶液,
向其中一支试管中加入FeCl3溶液
探究FeCl3溶液对H2O2分解速率的影响
参考答案:C
本题解析:
本题难度:一般
3、实验题 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。??

(1)按图连接好实验装置。检查装置的气密性,方法是_____________。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是________________。
(3)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后________;
④拆除装置,取出产物。
(4)数据记录如下:

①计算得到实验式CaxN2,其中x=________。
②若通入的N2中混有少量O2,请比较x与3的?大小,并给出判断依据:________。
参考答案:(1)关闭活塞K,微热反应管,试管A水中有气泡冒出,停止加热
本题解析:
本题难度:一般
4、简答题 某校化学兴趣小组为探究铜的常见化合物性质,提出了如下问题进行探究.请你协助该小组的同学完成下列探究活动.
提出问题①CuO能否被NH3还原?②如何安全的进行“钠投入CuSO4?溶液反应”的实验?
资料卡片Cu2O是红色粉末.Cu+在酸性溶液中能发生自身氧化还原反应生成Cu2+和Cu.
实验方案(1)为解决问题①,设计的实验装置如下(夹持及尾气处理装置未画出):
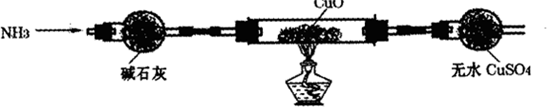
实验中观察到黑色CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.
(2)为解决问题②,该小组做了以下两组实验:
I.分别取40mL2%的CuSO4?溶液三份,各加入质量不同的钠块,实验现象如下:
| 钠块质量 | 实验现象
0.2g
钠块剧烈燃烧,发出爆炸声,少量的钠溅出
0.1g
钠块燃烧,发出爆炸声
0.05g
钠块四处游动,偶有轻微的爆炸声,未见钠块燃烧
II.保持钠块大小相同(约为0.05g),分别加入到不同浓度的CuSO4?溶液中,实验现象如下:
实验结论
(1)CuO能被NH3还原,该反应的化学方程式为______.
(2)在40mL2%的CuSO4?溶液,加入约______g的钠块是安全的.
问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O.你认为他的看法是否正确?______(填是或否),请你设计一个实验检验该红色物质中是否含有Cu2O.______.
(2)从“钠投入CuSO4?溶液反应”的实验结果来看,硫酸铜溶液的浓度越大,越容易发生爆炸.你认为可能的原因是什么?提出猜想,并设计实验检验你的猜想.猜想:______;检验方案______.
参考答案:实验结论(1)黑色CuO变为红色物质说明生成物为Cu,无水C
本题解析:
本题难度:一般
5、选择题 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
⑴方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是????????????????????????。
⑵方案二:按下图装置进行实验。并回答以下问题。
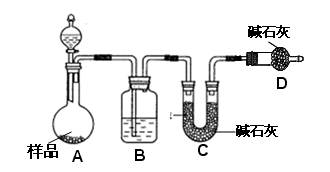
①实验前先_____________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是??????????????????????????。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是??????????????????????????????????????????????。
⑶方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是 ???????????????????????????????????????。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
参考答案:方案一(1) 保证NaHCO3全部分解??(2分)
方
本题解析:略
本题难度:简单
|