微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 还原铁粉是粉末冶金工业的重要原料,利用生产钛 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下:
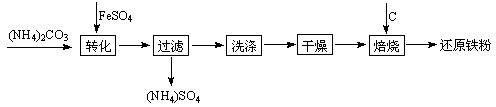
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为???????????????????????????????????????????。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为????????????????????????????????????,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、简答题 用含有Al2O3、SiO2和少量FeO?xFe2O3的铝灰制备Al2(SO4)3?18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是______.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:

?
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
注:金属离子的起始浓度为0.1mol?L-1
根据表中数据解释步骤Ⅱ的目的:______.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______.
②Ⅳ中加入MnSO4的目的是______.
参考答案:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al
本题解析:
本题难度:一般
3、实验题 某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题:
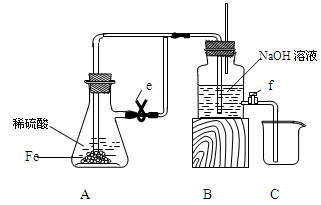
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
参考答案:(1)Fe + 2H+ = Fe2+ + H2↑ ?导管口有
本题解析:
试题分析:Fe与稀硫酸发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑其离子方程式为:Fe + 2H+ = Fe2+ + H2↑。A中产生的气体通过导气管到B的溶液中,会看到在导气管口产生气泡。(2)数分钟后夹上夹子e,A中还在继续反应产生气体,使容器A的气压增大,这时A中反应产生的FeSO4就会被压入到B容器中,与NaOH溶液反应产生白色Fe(OH)2沉淀。B中反应的离子方程式是H+ + OH-= H2O,Fe2+ + 2OH-= Fe(OH)2↓(3)如果开启活塞f放掉约2/3液体,
本题难度:一般
4、填空题 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④........
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)装置A中反应的化学方程式为????????????????????????。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是????????????????????????????????????????。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)???????????????????。
(4)装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:???????????????。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为????????????????????????。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为???????????????????????。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②??????????????????????????????????????????。
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)A中反应的化学方程式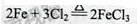
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质,第④的操作应该是:在沉积的的FeCl3固体下方加热。
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2,⑤用干燥的N2赶尽Cl2,
(4)装置D中FeCl2全部反应完后
本题难度:困难
5、简答题 把铁、氧化铁、氧化铜的混合物粉末放入110mL4mol?L-1盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200ml,测得其中c(H+)为0.4mol?L-1.试求:
(1)残留固体1.28g为:______(填化学 式);
(2)原混合物粉末中,m(CuO)=______g;
(3)滤液稀释到200mL后,c(Fe2+)=______mol?L-1;
(4)滤液加水稀释到200mL后,加入足量的硝酸银,产生的沉淀的物质的量:n(AgCl)=______mol;
(5)原混合物的总质量m(总)=______g.
参考答案:既然还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没
本题解析:
本题难度:一般
|