微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 丙
|
反应物投入量
| 1molCO .2molH2
| 1mol CH3OH
| 2molCO、4molH2
|
CH3OH的浓度(mol/L)
| c1
| c2
| c3
|
反应的能量变化
| 放出Q1 kJ
| 吸收Q2 kJ
| 放出Q3 kJ
|
平衡常数
| K1
| K2
| K3
|
反应物转化率
| α 1
| α 2
| α 3
①.容器内压强P:2P甲与2P乙与P丙关系是?????????
②.变化的热量数值Q中, Q1与Q2的和是????????????
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)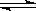 CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为???????????????????? CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为????????????????????
参考答案:① 2P甲等于2P乙且大于P丙?????????②Q1与Q2
本题解析:
(1)考查化学平衡中等效平衡知识。等温等容时反应前后气体体积变化的反应规律:将起始
投料量按化学计量系数之比换算成同一半边的物质,其物质的量与对应组分的起始投料量相
等,则建立的化学平衡是等效的,简称“等量等效”。这种情况下的等效平衡中的“等效”指
平衡体系中的各种性质( 各对应物的浓度、体积分数、转化率、物质的量) 是完全相同
的。类似于数学中的全等三角形,也可叫“全等平衡”。甲和乙容器内的平衡是完全相同的
平衡(等同平衡),各物理参数除热量都相同。由于体积不变,而1mol甲醇相当于是1molCO、
2moL H2,2mol甲醇相当于是2molCO、4moL H2,甲和乙中的平衡是等效的,则p甲=p乙;丙
相当于在乙的基础上增大压强,平衡向正反应方向进行,所以p丙<2p乙。
(2)甲和乙的反应是相反的,且平衡等效,所以Q1+Q2=90.8kJ。
(3)由于正反应是体积减小的、放热的可逆反应,所以升高温度,甲醇的含量降低。增大压强,甲醇的含量增大,所以图像是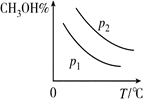 。 。
(4)原电池中负极失去电子,正极得到电子,所以而甲醚在负极通入,氧气在正极通入。根据装置图可判断,a处是负极,由于存在质子交换膜,所以负极电极反应式是 CH3OCH3 - 12e-+3H2O=2CO2+12H+。
本题难度:一般
2、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
网站客服QQ: 960335752 - 14613519 - 791315772