微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知水的电离方程式:H2O H++OH-,下列叙述正确的是 [???? ]
H++OH-,下列叙述正确的是 [???? ]
A.升高温度,Kw增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
参考答案:B
本题解析:
本题难度:一般
2、实验题 (14分)某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。
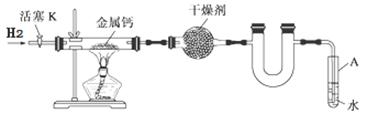
(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、 。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
参考答案:(14分)
(1)防止反应过程中空气进入反应管(1分)
本题解析:
试题分析:(1)试管A用液体封了导管口,所以能防止反应过程中空气进入反应管;通过氢气的气泡可以观察H2流速。(2)②因为金属钙容易和空气中的氧气反应,所以需要用氢气排除装置中的空气,所以通入氢气,收集气体并检验其纯度。④反应结束后,为了防止氢化钙被氧化,所以先熄灭酒精灯,待反应管冷却至室温,停止通H2并关闭活塞K。(3)氢化钙能和水反应生成氢氧化钙和氢气,方程式为:Ca+2H2O=Ca(OH)2+H2↑。(4)①配制溶液需要使用500mL容量瓶。②锥形瓶中滴加酚酞,溶液显红色,所以滴定的终点为加入最后一滴盐酸,整个溶液由红色变为无色,且半分钟不变色。③盐酸的物质的量为0.2500×0.02200=0.0055mol,所以原来产品中钙的物质的量为0.0055÷2×500÷25=0.055mol,假设钙的物质的量为xmol,氢化钙的物质的量为ymol,则有x+y=0.05540x+42y=2.30,解x=0.005mol,y=0.05mol,所以二者物质的量比为1:10。
考点:物质的制备,中和滴定,实验数据的处理
本题难度:困难
3、填空题 (16分)钢厂酸洗废液(成分如下表所示)在工业生产中还具有很多用途。
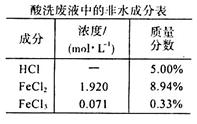
(1)欲检验该酸洗废液中含有的少量Fe3+,最宜选用的试剂是_____溶液;为检验其中的Fe2+,某同学设计了如下实验:取该酸洗废液少许加入试管中,滴入几滴酸性KMnO4溶液后发现紫色消失。该同学得出结论:该溶液中含有Fe2+。大家认为该同学的实验设计不合理,理由是____________________________(用必要的文字和离子方程式解释)。
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为______;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在__________(填“阴”或“阳”)极生成高铁酸钾(K2FeO4)。
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如下:
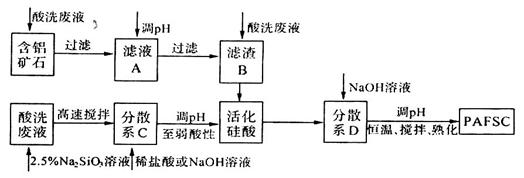
①适当调高滤液A的pH,Al3+和Fe2+转化为沉淀,原因是______________(请用沉淀溶解平衡的理论解释)。
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为________________。
③25℃时,PAFSC的除浊效果随溶液pH的变化如图所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是______(填下列序号字母)。
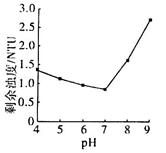
a.4~5 b.5~7 c.7~8 d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了_____现象。
参考答案:(1)(5分)KSCN;酸性KMnO4溶液会氧化Cl-,导致
本题解析:
试题分析:(1)检验该酸洗废液中含有的少量Fe3+,最宜选用的试剂是KSCN溶液;该酸性废液中的Fe2+、Cl-均有还原性,都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该同学的实验设计不合理,理由是酸性KMnO4溶液会氧化Cl-,导致紫色消失,2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。(2)用石墨作电极电解酸洗废液时,初始阶段,阳极板上Cl-放电生成氯气,电极反应式为2Cl--2e-=Cl2↑;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,Fe3+、Fe2+转化为FeO42—,化合价升高发生氧化反应,可在阳极生成高铁酸钾(K2FeO4)。(3)① 适当调高滤液A的pH,Al3+和Fe2+转化为沉淀,原因是调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp。②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+。③分析题给图像知,25℃时pH在5~7时PAFSC的除浊效果最佳,选b。25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了聚沉现象。
考点:以钢厂酸洗废液的再利用为载体考查离子检验,化学实验方案的分析、评价,电解原理,胶体的性质和应用及图像分析能力。
本题难度:困难
4、选择题 常温下,下列物质溶于水,水的电离被促进,且溶液的pH小于7的是( ? )
A.NaHSO4
B.KHCO3
C.AlCl3
D.HCl
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)某温度下,纯水中c(H+)?=?5×10-7?mol·L-1,则此时纯水中的c(OH-)?=?_________?mol·L-1;若温度不变,滴入稀硫酸使c(H+)?=?5.0×10-3?mol·L-1,则c(OH-)?=?____________?mol·L-1。
(2)已知室温下pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性,则高碘酸的电离方程式是__________________________。
参考答案:(1)5.0×10-7?mol·L-1????;???5.0
本题解析:
本题难度:一般