微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分散系中存在溶质的电离平衡的是
A 硝酸溶液?? B 氢氧化钙溶液? C硫酸钡悬浊液? D 氢氧化铜悬浊液
参考答案:D
本题解析:弱电解质存在电离平衡。氢氧化铜为弱碱,属于弱电解质。
本题难度:一般
2、选择题 下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则 ≤
≤
参考答案:C
本题解析:
试题分析:A、将pH=4的盐酸稀释后,溶液中氢离子和氯离子的浓度降低,但温度不变,Kw不变,氢氧根离子的浓度升高,错误;B、0.l0mol·L-1的氨水加水稀释后,虽然一水合氨的电离平衡正向移动,但由于溶液体积的增大起主要作用,溶液中c(NH4+)、c(OH-)变小,错误;C、Na2CO3水解呈碱性,常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变,正确;D、V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,若HA为强酸,则V1=V2,若HA为弱酸,则V1
本题难度:一般
3、填空题 (8分)常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3·H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是??????????(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)??????????????????????????。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是????????????????????。
(4)取10mL⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=????????mol/L.
参考答案:(1)①③(2分)
 本题解析:略
本题解析:略
本题难度:简单
4、选择题 关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是?
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
参考答案:B
本题解析:
试题分析:B、0.1 mol·L-1的①氨水、②盐酸对水的电离都起抑制作用,但是盐酸是强电解质,抑制作用会强一点,因此水电离出的c(H+):②<①,错误。
本题难度:一般
5、填空题 (10分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
(2)图是198 K时N2与H2反应过程中能量变化的曲线图。
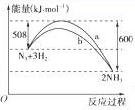
该反应的热化学方程式为:_____________________________________________________
(3)写出以下物质的电离方程式:
NaHCO3__________________________________________,
CH3COONH4_____________________________________,
H2CO3_____________________________________________
参考答案:(1)S(s)+O2(g)===SO2(g) ΔH=-296
本题解析:
试题分析:(1) 16 g固体硫的物质的量为0.5mol,1 mol固体硫完全燃烧放出的热量为296.8 kJ,所以热化学方程式为:S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1;(2)根据图示可知1 mol N2与3 mol H2反应生成2 mol NH3的焓变为-92 kJ·mol-1,热化学方程式为:N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1;(3)NaHCO3=Na+ +HCO3- ; CH3COONH4=CH3COO-+NH4+ ; H2CO3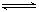 H+ +HCO3- HCO3-
H+ +HCO3- HCO3- H+ + CO32-。
H+ + CO32-。
考点:考查热化学方程式的书写,电离方程式的书写。
本题难度:一般