微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
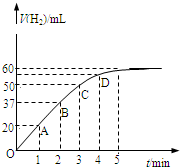
1、简答题 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
(1)A、B、C、D四点对应的化学反应速率由快到慢顺序为______.
(2)解释化学反应速率的大小变化原因______.
(3)在5min后,收集到的氢气体积不再增加,原因是______.
(4)下列叙述能说明上述反应达到最大限度的是______(填序号)
A.HI、H2、I2的物质的量之比为2:1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗2molHI,同时生成1molH2
D.混合气体的颜色不随时间的变化而变化
E.HI、H2、I2的生成速率之比为2:1:1.
参考答案:(1)根据v=△V
本题解析:
本题难度:一般
2、简答题 合成氨反应N2(g)+3H2(g)

2NH3(g)△H<0?具有重要的意义.
(1)该反应的化学平衡常数表达式是K=______.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | …
K
4.4×10-2
K1
K2
…
其中,K1______?K2(填“>”、“=”或“<”).
参考答案:(1)根据化学平衡常数=
本题解析:
本题难度:一般
3、简答题 如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)?

?xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系.

(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则______曲线表示无催化剂?(2)若乙图表示反映达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则______曲线表示恒温恒容的情况,此时该恒温恒容中C%______(填变大、表小或不变)
(3)根据丙图可以判断该可逆反应的正反应是______热反应(填放热或吸热),计量数值x的值______;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度T?的变化情况,根据你的理解,丁图的纵坐标可以是______
①C%????②A的转化率????③B的转化率????④压强????⑤c(A)????⑥c(B)
升温平衡移动的方向为______(填左移或右移)
参考答案:(1)催化剂改变反应历程,提高反应速率,缩短到达平衡的时间,
本题解析:
本题难度:一般
4、填空题 下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ·mol-1)
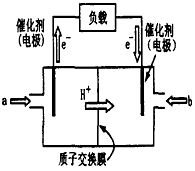
(1)该装置中______(填a或b)为电池的负极,其电极反应为____________。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g)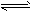
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=________;在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将________(填增大、减小、不变),其反应的正反应速率将________(填增大、减小、不变);逆反应速率将________(填增大、减小、不变);温度升高________(填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g) ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供________mol电子的电量。
参考答案:(1)a;CH3OH+H2O-6e-=CO2↑+6H+(2)
本题解析:
本题难度:一般
5、简答题 (1)研究硫及其化合物性质有重要意义.
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.
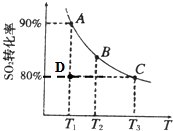
参考答案:(1)温度T1时,平衡点为A,D点二氧化硫转化率小于A,反应
本题解析:
本题难度:一般
|