H
?2
O(g)?
△H=594.1kJ/mol.请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式:______.
(3)硫酸工业生产中,SO2催化氧化生成SO3反应为2SO2+O2?2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图.
根据图示回答下列问题:
①2SO2(g)+O2(g)+O2(g)?2SO3(g)的△H______0?(填“>”或“<”).
②若温度T1、T2时,反应的化学平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(填“>”“<”或“=”).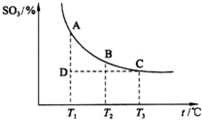
参考答案:(1)a.大量化石燃料的燃烧是二氧化碳的主要来源,减少化石燃
本题解析:
本题难度:一般
2、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。

①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
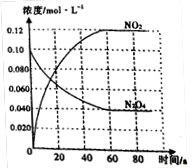
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
参考答案:(1)① <(1分) ②逐渐减小(1分)
本题解析:
试题分析:(1)①反应是气体体积减少的反应,温度相同时压强越大,平衡向正向移动,NO的转化率就越大,P2下的转化率比P1大,故P2较大,则P1<P2,②压强相等时,温度升高NO的转化率减小。故升高温度平衡向逆向移动,平衡常数减小。(2)反应的△H<0,所以反应是放热反应,NO2的能量较高,同种物质气态的能量比液态高,故A对。(3)①从图看出0~60s 时段,NO2的浓度改变了0.12mol/L,则NO2反应速率为:0.12mol/L÷60s=" 0.0020" mol/(L·s)。 ②2NO2(g) N2O4(g) △H<0则N2O4(g)
N2O4(g) △H<0则N2O4(g) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
(4)从反应方程式看出N 的化合价升高,失去电子,故在负极反应;NH3在负极反应,那么O2在正极反应,电解质溶液是碱性的,电极反应为:3O2+ 6H2O + 12e-=12OH-(2分)
考点:化学平衡图像、化学平衡的移动、化学平衡常数的计算、燃料电池的工作原理。
本题难度:困难
3、选择题 水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol。
(1)生成物能量总和(填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
(3)氢气热值为 。
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图所示:a、b两个电极均由多孔的碳块组成。
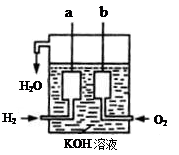
(1)a电极反应式是
(2)b电极反应式是
Ⅲ、如图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。
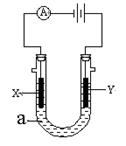
(1)X极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,
检验该电极反应产物的方法是 。
参考答案:Ⅰ(1) 小于(2) <(3) 143 kJ/g
Ⅱ、
本题解析:
试题分析:Ⅰ、(1)该反应正反应为放热反应,生成物的总能量小于反应物总能量。(2)气态水的能量高于液体水,故生成2mol气态水放出的热量小于572kJ。(3)值指1kg燃料完全燃烧放出的热量,由热化学方程式可知,1kg氢气燃烧放出的热量为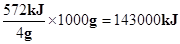 ,故氢气的热值为143kJ/g。
,故氢气的热值为143kJ/g。
Ⅱ、(1)a极通入H2,发生氧化反应,在碱性条件下生成水,电极反应式为:H2 + 2OH
本题难度:一般
4、选择题 己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。 则HCN在水溶液中电离的△H等于 ( )
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7kJ/mol
参考答案:C
本题解析:
试题分析:根据能量守恒定律可知,HCN在水溶液中电离的焓变ΔH等于-12.1 kJ·mol-1+55.6 kJ·mol-1=+43.5 kJ·mol-1,答案选C。
考点:考查盖斯定律的有关应用。
本题难度:一般
5、简答题 已知热化学方程式:
Mg(OH)2(S)=MgO(S)+H2O(g);△H1=+81.5kJ/mol
Al(OH)3(S)=
1
2
Al2O3(S)+2
3
H2O(g);△H1=+87.7kJ/mol
(1)Mg(OH)2和Al(OH)3起阻燃作用的主要原因是______.
(2)等质量Mg(OH)2和Al(OH)3起阻燃作用效果较好的是______.
参考答案:(1)Mg(OH)2和Al(OH)3受热分解时吸收大量的热,
本题解析:
本题难度:一般
|
|