微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量是 ???????????????????????????????( ???)
A.水的摩尔质量
B.1mol水蒸气的质量
C.1mol水的体积
D.1mol水蒸气的体积
参考答案:D
本题解析:略
本题难度:一般
2、填空题 (1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为______,摩尔质量之比为______.
(2)在标准状况下a.6.72L?CH4气体???b.3.01×1023个HCl气体分子????c.13.6g???H2S气体??d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量______,
②标准状况下四种气体的体积______,
③四种气体的质量______.
参考答案:(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比
本题解析:
本题难度:一般
3、选择题 摩尔是物质的量的单位,是七个基本单位之一。在学习物质的量有关知识时,我们可以以熟悉的质量和 kg的相互关系进行类比理解。下列对“摩尔(mol)”的叙述不正确的是[???? ]
A.摩尔是一个单位,可用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
参考答案:D
本题解析:A.摩尔是一个单位,可用于计量物质所含微观粒子的多少,1mol物质含有阿伏加德罗常数个微观粒子,A正确;
B.摩尔既能用来计量纯净物,又能用来计量混合物,B正确;?
C.1 mol任何气体所含的气体分子数目都相等,它们都含有阿伏加德罗常数个分子,C正确;
D.“摩尔”是物质的量的单位,“个”是微粒数的单位;“纳米”和“米”都是表示长度的单位。前者计量思路不是扩大单位。
本题难度:简单
4、选择题 NA代表阿伏加德罗常数,下列说法正确的是( )
A.2.3g钠由原子变成离子时,失去的电子数为0.2 NA
B.0.2 NA个硫酸分子与19.6g磷酸(H3PO4)含有相同的氧原子数
C.28g氮气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
参考答案:B
本题解析:
试题分析:2.3g钠的物质的量是0.1mol,失去的电子为0.1mol,为0.1NA,A错误.19.6g磷酸的物质的量是0.2mol,硫酸与磷酸都含有4个氧原子,故0.2NA硫酸分子与19.6g磷酸含有相同的氧原子数,B正确;28g氮气是1mol,原子数为2NA,C错误;NA个氧分子与NA个氢分子的质量比为32:2=16:1,D错误。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
5、计算题 (10分)将体积为100 mL浓度为2.0 mol?L?1 的CuSO4溶液和体积为300 mL浓度为1.0 mol?L?1 的H2SO4溶液混合,假定混合后溶液体积为400 mL。计算:
(1)混合液中CuSO4的物质的量浓度是????,H2SO4的物质的量浓度是????。
(2)往混合液中加水稀释至Cu2+ 浓度为0.2 mol?L?1,则稀释后溶液的体积为????????????。
(3)稀释后溶液中H+ 的物质的量浓度是????,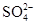 的物质的量浓度是?????。
的物质的量浓度是?????。
参考答案:(1) 0.5 mol?L?1??? 0.75 mol?L?
本题解析:
试题分析:(1)n(CuSO4)=0.2mol?????? n(H2SO4)=0.3mol,混合后溶液的体积为400mL,所以c(CuSO4)=0.5mol/L? c(H2SO4)=0.75mol。
(2)根据c(稀)V(稀)=c(浓)V(浓)有0.2 mol?L?1×V=0.5mol/L×400mL,则V=1000mL。
(3)n(H+)=0.6mol? n(SO42-)=0.3mol,溶液体积为1L,则c(H+)=0.6mol/L,c(SO42-)=0.3mol/L。
点评:
本题难度:一般