微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语正确的是
A.质子数为53、中子数为78的碘原子:
B.Na218O中氧离子的结构示意图:
C.甲烷的比例模型
D.氯化镁的电离方程式MgCl2 (熔融)= Mg + Cl2↑
参考答案:B
本题解析:A错误,元素符号的左下角是质子数,左上角是质量数(质子数与中子数之和)。
B正确
C错误,该模型是球棍模型,比例模型中没有棍式结构,所有原子靠拢在一起。
D错误,正确的电离应该是:MgCl2 (熔融)= Mg2++ 2Cl-。
本题难度:一般
2、选择题 “问题胶囊”已成为公众关注的热点,胶囊中铬含量超标对人体有害。请计算重铬酸钾(K2Cr2O7)中铬元素(Cr)的化合价(????)
A.+3
B.+6
C.+7
D.+12
参考答案:B
本题解析:由于K和O的化合价分别是+1和-2价,所以根据正负价代数和为0可知,Cr的化合价是+6价,答案选B。
本题难度:一般
3、选择题 下列有关化学用语使用正确的是:
A.HCl的电子式:
B.NH4Cl的电子式: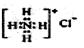
C.硫离子的离子结构示意图:
D.丙烯CH2=CH-CH3可通过聚合反应生成: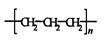
参考答案:C
本题解析:略
本题难度:一般
4、选择题 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是
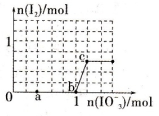
A.还原性:HSO3->I-,氧化性:IO3->I2>SO42-
B.a点处的氧化产物是SO42-,还原产物是I-
C.当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol
D.若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
参考答案:C
本题解析:
试题分析:根据图像可知开始阶段没有碘生成,这说明首先发生的反应应该是IO3-+3HSO3-=I-+3SO42-+3H+。在氧化还原反应中还原剂的还原性强于还原产物的还原性,因此还原性HSO-3>I-;继续加入KIO3,出现单质碘,这说明此时发生的反应为IO3-+6H++5I-=3H2O+3I2。在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,因此氧化性IO3->I2。则 A、根据以上分析可知还原性:HSO3->I-,氧化性:IO3->I2>SO42-,A正确;B、a点处亚硫酸氢钠过量,则氧化产物是SO42-,还原产物是I-,B正确;C、3mol亚硫酸氢钠最多消耗1mol碘酸钾,产生1mol碘离子,但碘酸钾可以氧化碘离子,所以当溶液中的I-为0.4mol时,加入的KIO3不一定为0.4mol,C错误;D、根据以上分析可知若向KIO3溶液中滴加NaHSO3溶液,碘酸钾过量,可以生成单质碘,因此反应开始时的离子方程式为2IO3-+5HSO3-=I2+5SO42-+3H++H2O,D正确,答案选C。
考点:考查离子反应、氧化还原反应的有关判断与计算
本题难度:困难
5、选择题 常温下,在100ml12mol?L-1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积为(不考虑NO2转化为N2O4)( )
A.几乎无气体产生
B.等于6.72L
C.等于13.44L
D.介于6.72L至13.44L之间
参考答案:12mol?L-1的浓HNO3是浓硝酸,在常温下,铁在浓硝酸
本题解析:
本题难度:一般