微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学与数学有密切的联系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中不正确的是[???? ]
A.铁与稀硝酸反应后溶液中铁元素的存在形式 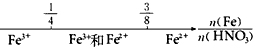
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 
C.分散系的分类 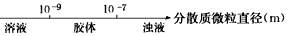
D.CO2通入澄清石灰水中反应的产物 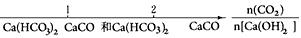
参考答案:D
本题解析:
本题难度:一般
2、选择题 用铝粉和氧化铁粉末配成的铝热剂,分成两等份:一份在高温下恰好完全反应,再与足量稀硫酸反应,生成氢气aL;另一份直接放入足量烧碱溶液中充分反应,在相同条件下生气氢气bL,则体积比a:b为( )
A.1:1
B.3:2
C.2:3
D.1:4
参考答案:令每份都含有1molAl.
对于在高温下恰好完全反应,
本题解析:
本题难度:简单
3、选择题 某镁铝合金中,镁与铝物质的量之比为1:1,将两份质量相等的镁铝合金分别与足量的盐酸、NaOH溶液反应,生成气体的物质的量之比为
A.5:3
B.1:2
C.3:5
D.2:3
参考答案:A
本题解析:由反应:Mg+2HCl=MgCl2+H2↑??? 2Al+6HCl=AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
可看出,两次生成的气体的物质的量之比为5:3
本题难度:一般
4、选择题 甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
参考答案:B
本题解析:氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,但不能溶于氨水中,所以如果氢氧化钠过量,则氢氧化铝就会溶解,因此正确的答案选B。
本题难度:一般
5、简答题 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是??????????。
(2)下列处理SO2的方法,不合理的是_____?
A高空排放???????????????????????????? B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵????D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有????????????。
A过滤?? B加过量NaOH溶液??????? C蒸发结晶? D灼烧???? E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示
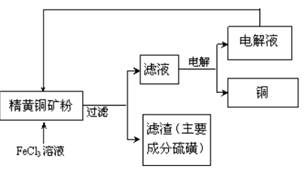
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是???????????(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为???????mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
参考答案:(1)CuFeS2、O2
(2)A、D
(3)C
本题解析:(1)根据所给的方程式知,硫元素的化合价升高,铜元素从+2降到0价,因此CuFeS2、O2是氧化剂;
(2)SO2是大气污染物,不能随意排放,A错;用纯碱溶液吸收制备亚硫酸钠,可以防止污染,B正确;用氨水吸收,再经氧化制备硫酸铵,也可以防止污染,C正确;SO2不能溶于氯化钡溶液,D错;
(3)炉渣的主要成分是FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3,加盐酸溶解后,需要过滤出SiO2,然后再加入氧化剂将溶液中的亚铁离子氧化为三价铁离子,再加入过量的氢氧化钠溶液生成氢氧化铁沉淀
本题难度:一般