微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用瓷坩埚盛放镁粉进行强热使之燃烧,充分反应后生成的固体产物可能有(???)
A.2种
B.3种
C.4种
D.5种
参考答案:D
本题解析:镁粉在空气中燃烧时,镁粉除与氧气化合形成MgO外,还能与N2、CO2反应生成Mg3N2和C、MgO。但在瓷坩埚里高温燃烧时镁还能与瓷坩埚中的SiO2反应生成Si:
SiO2+2Mg 2MgO+Si
2MgO+Si
Si与Mg也可能反应生成Mg2Si:
Si+2Mg 本题难度:简单
本题难度:简单
2、选择题 用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
①Fe H2
H2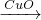 Cu??????②CuO
Cu??????②CuO CuSO4
CuSO4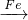 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量
A.一样多
B.①多
C.②多
D.无法判断
参考答案:C
本题解析:分析:写出两个方案中所发生的反应的化学方程式,根据质量守恒定律及氢气还原氧化铜的实验步骤进行分析解答.
解答:两方案中所发生的化学方程式为:①Fe+H2SO4═FeSO4+H2↑;H2+CuO ??Cu+H2O;
??Cu+H2O;
②CuO+H2SO4═CuSO4+H2O;Fe+CuSO4═Cu+FeSO4;
方案①中氢气还原氧化铜实验,开始时需先通入一部分氢气,排除装置中的空气,实验结束时还要通一会氢气,以防止生成的铜被氧化,如果不考虑先通后停,相同质量的铁生成铜的质量是相同的,但是由于部分氢气被浪费,从而导致铁的质量被多消耗一部分,所以导致方案①对应的铜减少.故方案②生成的铜多,分析选项可知选项C是正确的;
故选 C.
点评:本题考查了制备物质的不同途径中,方案不同,产物不同;生成产物的量的多少由反应物决定,参加反应的物质要根据实验过程实际用量进行确定.
本题难度:简单
3、选择题 下列实验或图表的结论或解释正确的是( )
| 实验或图表 | 结论或解释
A
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔表面生成的氧化物具有高熔点
B
某CH3COOH和CH3COONa组成的酸性溶液中,加入一定量氨水
c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
C
该反应热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol

D
铁制容器可用于盛装冷的浓硫酸
铁与浓硫酸不反应
A.A
B.B
C.C
D.D
参考答案:A、氧化铝的熔点比铝的熔点高,铝箔在酒精灯火焰上加热熔化但不
本题解析:
本题难度:简单
4、选择题 下列物质既能与盐酸反应,又能与烧碱溶液反应的是
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧NaHSO3[???? ]
A、除⑥外
B、除⑥、⑦、⑧外
C、除⑥、⑦外
D、除①、②、③、④、⑤外
参考答案:C
本题解析:
本题难度:简单
5、选择题 工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S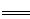 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
Al+3NiO(OH)+NaOH  ??NaAlO2+3Ni(OH)2 ??NaAlO2+3Ni(OH)2
参考答案:C
本题解析:
试题分析:4KAl(SO4)2·12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,氧化剂是KAl(SO4)2·12H2O,还原剂是硫单质;
4KAl(SO4)2·12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
↓2×2×3???↑4×3
所以还原剂与氧化剂的物质的量之比是1:1,A选项不正确根据电荷守恒,c(H+)+c(NH4+)=c(OH―)+2c(SO42―
本题难度:一般
|