微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在25℃时,用石墨电极电解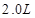 ,
,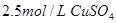 溶液,如有
溶液,如有 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的 的质量是 ,得到
的质量是 ,得到 的体积(标准状况)是 。
的体积(标准状况)是 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的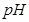 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)
参考答案:(1)还原 Cu2++2e-=Cu (
本题解析:
试题分析:(1)惰性电极电解硫酸铜溶液,阴极发生还原反应,则溶液中的铜离子在阴极得到电子而析出,电极反应式是Cu2++2e-=Cu。
(2)惰性电极电解硫酸铜溶液,阳极失去电子,发生氧化反应。则溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O+O2↑。
(3)反应中注意0.20mol电子,则根据反应式Cu2++2e-=Cu可知,析出0.10mol铜,质量是6.4g。根据反应式4OH--4e-=2H2O+O2↑可知,生成氧气的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
(4)如用等质量的两块铜片代替石墨作电极,则阳极是铜失去电子,质量减少6.4g。阴极是溶液中的铜离子得到电子,析出6.4g铜,所以电解后两铜片的质量相差12.8g,而溶液中的浓度不变,则pH不变。
考点:考查电解池的有关判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确电解池的工作原理,并依据电子得失守恒计算,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
2、选择题 下列为原电池装置的是
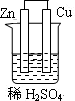
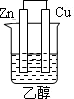
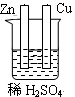
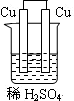
A B C D
参考答案:A
本题解析:
试题分析:构成原电池的条件是活泼性不同的金属(或金属与非金属)用导线相连并插入到电解质溶液中,所以A装置是原电池,B中乙醇是非电解质,C中电极没有相连,D中电极相同,均不能构成原电池,所以正确的答案选A。
考点:考查原电池构成的有关判断
点评:该题是基础性试题的考查,试题难易适中,注重基础,侧重能力的训练。该题的关键是明确构成原电池的条件,并能灵活运用即可,有利于学生的逻辑推理能力。
本题难度:一般
3、填空题 生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
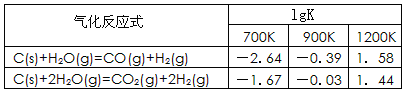
反应:CO(g)+H2O(g)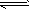 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2?CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
参考答案:(1)<; 0.36 (2
本题解析:
试题分析:K1="{" C(CO)·C(H2)} /C(H2O);K2=" {" C(CO2)·C2(H2)} /C2(H2O) ②-①整理得:CO(g)+H2O(g)  CO2(g)+H2(g),它的平衡常数为:K="{" C(CO2)·C(H2)} /{ C(CO) ·C(H2O)}.="K2/K1." K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK ="lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36." (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g) △H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O.②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+ H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+
CO2(g)+H2(g),它的平衡常数为:K="{" C(CO2)·C(H2)} /{ C(CO) ·C(H2O)}.="K2/K1." K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK ="lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36." (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g) △H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O.②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+ H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+ Cu2++H2↑。
Cu2++H2↑。
考点:考查原电池、电解池的反应原理及化学平衡常数的计算、热化学方程式的书写等知识。
本题难度:困难
4、填空题 下图装置中不能组成原电池的是____。
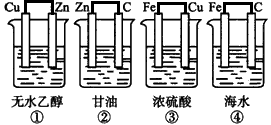
参考答案:①②
本题解析:
本题难度:一般
5、选择题 在电解水时,常加入一些稀硫酸,其目的是
A.使溶液酸性增强
B.使溶液中离子浓度减小
C.提高溶液的导电性
D.使溶液的氧化性增强
参考答案:C
本题解析:
正确答案:C
2H2O 2H2↑+O2↑,水难电离,导电能力差,可以加Na2SO4,H2SO4,NaOH等易电离又不参与反应的物质,增强导电性。
2H2↑+O2↑,水难电离,导电能力差,可以加Na2SO4,H2SO4,NaOH等易电离又不参与反应的物质,增强导电性。
本题难度:简单