微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g)  ?x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
?x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为0.2 mol/L
D.N的转化率为80%
参考答案:D
本题解析:采用“三段式”计算
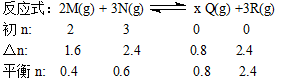
从以上数据可看出:x=1,平衡时N的浓度为0.3 mol/L,N的转化率为80%
由于气体的体积及质量均不变,故密度也是定值
答案为D
本题难度:一般
2、选择题 一定条件下,可逆反应X (g) + 3 Y (g) 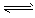 2Z (g) ,若X、Y、Z起始浓度分别为C1、C2、C3、(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 [???? ]
2Z (g) ,若X、Y、Z起始浓度分别为C1、C2、C3、(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 [???? ]
A.C1:C2 = 1:3
B.X、Y的转化率不相等
C.平衡时,Y与Z的生成速率之比为3:2
D.C1的取值范围为0<C1<0.14
参考答案:B
本题解析:
本题难度:一般
3、选择题 有一处于平衡状态的反应:A(g)+3D(g) 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
A.①、③和⑥
B.②、③和⑥
C.①、④和⑥
D.②、③、⑤和⑥
参考答案:B
本题解析:
试题分析:反应A(g)+3D(g) 2E(g),ΔH<0,是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出E,即减小生成物的浓度,平衡正向移动,故⑥正确.故选B。
2E(g),ΔH<0,是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出E,即减小生成物的浓度,平衡正向移动,故⑥正确.故选B。
点评:根据影响化学平衡移动的因素:温度、压强、浓度等回答。
本题难度:简单
4、填空题 (10分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0??试回答下列问题:
CO2(g)+H2(g) △H<0??试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L -1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=???????????
-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=???????????
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1,c(CO)
=c(CO2)="1" mol·L-1, c(H2)="1.5" mol·L-1,则此时该反应是否达到平衡状态????(选填“是”与“否”),此时v正???v逆(选填“ 大于”、“小于”或“等于”)。
大于”、“小于”或“等于”)。
(3)平衡时若降低温度,该反应的K值将???????(选填“增 大”、“减小”或“不变”),
大”、“减小”或“不变”),
平衡??????移动(选填“正向”、“逆向”或“不”)。
参考答案:(1)1????????(2)否;大于???????(3)增
本题解析:略
本题难度:一般
5、填空题 (1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是???????(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= ?mol·L-1·min-1
?mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时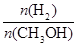 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为???????。
参考答案:(1)③④???(2)1- 本题解析:(1)根据图像中的数据可知,温度T1时生成甲醇的速率=nA/2tA mol·L-1·min-1,故①错误;读图可知,温度从T1升高到T2时,甲醇的物质的量降低,说明平衡逆向移动,故此时平衡常数减小,故②错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,故③正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故④正确。
本题解析:(1)根据图像中的数据可知,温度T1时生成甲醇的速率=nA/2tA mol·L-1·min-1,故①错误;读图可知,温度从T1升高到T2时,甲醇的物质的量降低,说明平衡逆向移动,故此时平衡常数减小,故②错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,故③正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故④正确。
(2)写出方程式CO2+3H2 CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) www.91exAm.org mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为(4-2α)/4=(2-α)/2。
CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) www.91exAm.org mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为(4-2α)/4=(2-α)/2。
本题难度:一般