微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g) +H2O(g)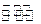 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):

(1)用H2表示反应在t1min内的平均速率为v(H2)= ________________。
(2)保持其他条件不变,若起始时向容器中充入1.50m olCO和1.00molH2O(g),达到平衡时,n(CO2)=________________。
(3) 保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将? ______?。
保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将? ______?。
(4)保持其他条件不变,若起始时向容器中充入amolCO和bmolH2O(g),达到平衡时,CO2的体积分数为24 %,a、b的值须满足的条件是________________。
(5)温度升至T2℃,上述反应的平衡常数为0.64,则正反应的△H____ 0(填>或<)。
参考答案:(1)0.30/t1 mol·L―1·min―1
(2
本题解析:略
本题难度:一般
2、填空题 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知: 的平衡常数随温度的变化如下表
的平衡常数随温度的变化如下表
温度/℃
400
500
800
平衡常数Kc
9.94
9
1
试回答下列问题:
(1)上述正向反应是:___________反应(选填:放热、吸热)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
__________(选填A、B、C、D、E)

(3)已知在一定温度下:
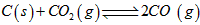 平衡常数K
平衡常数K
 平衡常数K1
平衡常数K1
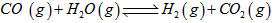 平衡常数K2
平衡常数K2
则K、K1、K2之间的关系是_________________
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:
________________
(5)若在800℃时进行,设起始时CO和H2O共为5mol,水蒸气的体积分数为x,平衡时CO转化率为y,则y随x变化的函数关系式为:y=__________________
(6)在VL密闭器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变)。将混合气体燃烧,测得放出的热量为2842kJ(已知燃烧1molCO放热283KJ,燃烧
1molH2放热为286KJ) 则T℃平衡常数K=_________________
参考答案:(1)放热
(2)BCE
(3)K=K1/K2
本题解析:
本题难度:困难
3、选择题 已知N2+3H2=2NH3 △H<0,硫化氢难电离。下列事实不能用勒夏特列原理解释的是:
A.给硫化氢水溶液中加碱有利于S2-的生成
B.加入催化剂有利于氨的氧化反应
C.高压有利于合成氨反应
D.500℃左右比室温更利于合成氨的反应
参考答案:AD
本题解析:
正确答案:AD
A、给硫化氢水溶液中加碱,H2S H++HS― ,平衡向电离方向移动,有利于S2-的生成;B. 加入催化剂有利于氨的氧化反应,对平衡没有影响; C. N2+3H2=2NH3,是体积缩小的反应,高压有利于合成氨反应;??? D. 500℃左右比室温更利于合成氨的反应,500℃时催化剂活性最好。
H++HS― ,平衡向电离方向移动,有利于S2-的生成;B. 加入催化剂有利于氨的氧化反应,对平衡没有影响; C. N2+3H2=2NH3,是体积缩小的反应,高压有利于合成氨反应;??? D. 500℃左右比室温更利于合成氨的反应,500℃时催化剂活性最好。
本题难度:一般
4、填空题 (16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号)????????????????。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
?
①反应的平衡常数表达式为K=??????????。由上表数据判断,该反应的△H????0(填“>”、“=”或“<”)。升高温度,正反应速率???????(填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为????????,此时的温度为?????????。
(3)欲提高CO的转化率,可采取的措施是????????????????。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
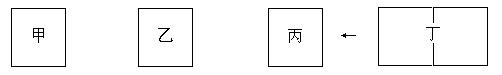
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 丙
| 投料方式
| 1molCO、2molH2
| 1molCH3OH
| 2molCH3OH
| 平衡数据
| C(CH3OH)/(mol/L)
| c1
| c2
| c3
| 体系压强(Pa)
| p1
| p2
| p3
| 反应的能量变化
| akJ
| bkJ
| ckJ
| 原料转化率
| α1
| α2
| α3
?
下列分析正确的是?????????????。(填序号)
A.2c1<c3????????B.2 p1<p3?????C.|a|+|b|=90.8???? D.α1+α3>1
参考答案:
(1)BD(答对一个给1分)
(2)①
本题解析:
试题分析:(1)A、同一方向,错误;B、反应中气体的总物质的量变化,气体的质量不变,所以相对分子质量是变量,当不变时达到平衡,正确;C、密度是定值,错误;D、气体的压强与物质的量成正比,压强是变量,当不变时达到平衡,正确。(2)温度升高,K变小,反应放热;升高温度正逆反应速率均增大;通过平衡计算的三步法直接计算可得;(3)A、升温平衡逆向移动,转化率降低,错误;B、催化剂不改变平衡状态,错误;C、加入CO,其转化率降低,错误;D、加入氢气,增加CO转化率,正确;E、恒容条件下通入不反应的气体不能不移动,错误;F、降低生成物浓度,平衡正向移动,反应物转化率提高,正确;
(4)根据题意,把丙设置为丁,则甲乙丁为等效平衡,把丁压缩到一个容器中,增大压强,平衡向生成甲醇的方向移动,故有2c1<c3 ,压强2 p1>p3;甲乙是从两个不同方向进行到同一个平衡,故有
|a|+|b|=90.8 ,α1+α2 =1,丙中甲醇转化率小,故有α1+α3<1。
本题难度:困难
5、选择题 在一定条件下,将1 mol CO和1 mol水蒸气通入容器中发生下述反应:CO+H2O CO2+H2,达到平衡后,测得CO2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为 CO2+H2,达到平衡后,测得CO2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为
A.0.7mol
B.0.8mol
C.0.6mol
D.0.9mol
参考答案:A
本题解析:第一次平衡后再通入0.3 mol水蒸气平衡向右移动,达新平衡时二氧化碳的物质的量一定大于0.6摩尔,故排除答案C;依平衡移动原理0.3 mol水蒸气不会全部转化为二氧化碳及氢气,从而排除答案D;又依平衡移动原理知新平衡下的反应物转化率一定小于前次平衡的转化率,而第一次平衡时水蒸气的转化率为百分之六十,按此计算0.3*60/100=1.8摩尔,0.6+1.8=7.8摩尔,而达新平衡时二氧化碳的物质的量应小于7.8摩尔,排除B,而选A。
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772