微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _ ______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:
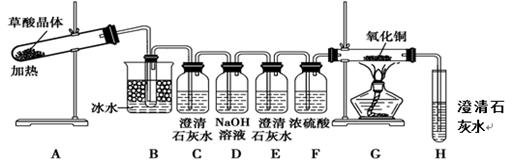
①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式: 。
②上述装置中,B装置的作用是 。 D的作用是 。从环境保护角度来看,该方案的不足之处是 。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
参考答案:(1)HCO3—+H2C2O4 =HC2O4—+CO2↑+H
本题解析:
试题分析:(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生,该气体是CO2,反应的离子方程式为HCO3—+H2C2O4 =HC2O4—+CO2↑+H2O。
(2)①溶液开始缓慢褪色,后来迅速变成无色,这说明高锰酸钾被还原,因此该实验说明草酸具有还原性。该反应的反应速率先慢后快,由于反应热效应不明显,这说明速率增大的原因是催化剂引起的,所以可能的原因是反应产生的锰离子起催化作用或锰离子浓度增加,加快了反应速率。
②反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。碳元素的化合价从+3价升高到+4 价,失去1个电子,则根据电子得失守恒和原子守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
(3)①C、H装置均变浑浊,这说明草酸分解有CO2产生。E处无现象,G玻璃管里黑色变红色,数目氧化铜被还原为金属铜,因此根据H中石灰水变浑浊可知草酸分解还有CO产生,所以A中反应的化学方程式为H2C2O4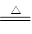 H2O +CO↑+CO2↑。
H2O +CO↑+CO2↑。
②由于草酸易挥发,能与石灰水反应,从而干扰CO2的检验,所以上述装置中,B装置的作用是冷凝草酸蒸气,避免对二氧化碳的检验产生干扰。为防止反应产生的CO2干扰CO的检验,需要氢氧化钠溶液吸收CO2,即D的作用是除去混合气体中的CO2。CO有毒,需要尾气处理,因此从环境保护角度来看,该方案的不足之处是没有尾气处理装置。
(4)2.52 g草酸晶体的物质的量=2.52g÷126g/mol=0.02mol,氢氧化钠的物质的量是0.1L×0.2mol/L=0.02mol,所以二者反应后恰好生成NaHC2O4。测得反应后溶液呈酸性,说明HC2O4—的电离程度大于HC2O4—的水解程度,所以形成的溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4—)>c(H+)>c(C2O42—)>c(OH-)。
考点:考查氧化还原反应、外界条件大于反应速率的影响、气体检验以及溶液中离子浓度大小比较
本题难度:一般
2、选择题 下列所述事实与化学(或离子)方程式不相符的是 ( )
A.能说明NH3结合H+能力比H2O强:N H3+H2O
H3+H2O NH4++OH-
NH4++OH-
B.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O
C.能说明盐酸的酸性比碳酸强:2HCl+CaCO3=CaCl2+H2O+CO2↑
D.能说明CH3COPH是弱酸:CH3COO-+H2O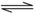 CH3COOH+OH-
CH3COOH+OH-
参考答案:A
本题解析:略
本题难度:一般
3、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+
参考答案:B
本题解析:
试题分析:A、氢氧燃料电池中的负极发生氧化反应,所以氢气失去电子,因为电解质为碱性,所以氢气失去电子与氢氧根离子结合生成水,错误;B、电解饱和食盐水时,阳极时氯离子放电生成氯气,正确;C、精炼粗铜时,粗铜应该失去电子进入溶液,所以粗铜做阳极,纯铜作阴极,与电源正极相连的是粗铜,错误;D、钢铁发生电化学腐蚀时,正极发生还原反应,所以时氧气得到电子生成氢氧根离子,错误,答案选B。
考点:考查电化学反应原理的应用,电极反应式书写的判断
本题难度:一般
4、填空题 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。
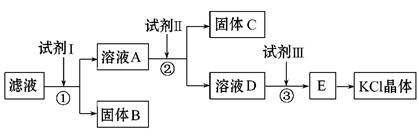
回答下列问题:
(1)试剂Ⅰ的化学式为 ,①中发生反应的离子方程式为
。
(2)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 。
(3)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 。
(4)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用硝酸银溶液反应共消耗硝酸银0.002 562 mol,则该产品的纯度为
。
参考答案:(1)BaCl2  本题解析:
本题解析:
试题分析:(1)要除掉杂质离子硫酸根离子和碳酸根离子,应加入过量的钡离子,又不能引入其他离子,因此选用BaCl2溶液,与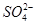 和
和 均能反应。
均能反应。
(2)要除掉多余的钡离子,所需试剂必须既能除去过量的Ba2+,又不能引入其他杂质且过量离子较易除去,因此选用K2CO3。
(3)要除掉多余的碳酸根离子,要滴加过量的盐酸。
(4)硝酸银的物质的量就是氯化钾的物质的量,则纯度为0.002 562×74.5×4÷0.775 9=0.984 0;另外从本题所给数据来看需保留四位有效数字。
考点:常见物质的检验、分离和提纯,化学计算
本题难度:一般
5、填空题 (16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:

请回答下列问题:
(1)操作i所需要的玻璃仪器有: (填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。
(4)写出生成固体H的离子方程式 。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为 。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
滴定次数
| 1
| 2
| 3
| 4
|
KI溶液体积/mL
| 30.00
| 32.20
| 30.02
| 29.98
则该粉煤灰中Fe元素的质量分数为 (保留三位有效数字)。
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。
参考答案:(1)b、d、g(选对2个得1分,全对得2分)。
(2
本题解析:(1)操作i是过滤,需要用到的玻璃仪器有:烧杯、玻璃棒、漏斗。
(2)粉煤灰中SiO2与Al2O3分别与过量NaOH溶液反应的离子方程式:SiO2+2OH-=SiO32-+H2O;Al2O3
+2OH-=2AlO2-+H2O。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2的目的是将Fe2+氧化为Fe3+,发生反应的离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O。
(4)固体H的主要成分Al2O3是溶液F中的Al3+与NH3反应生成的,其离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(5)①加热煮沸的目的是让过量的H2O2完全分解,以防止干扰后面的滴定实验,化学方程式为:2H2O2=2H2O+O2↑。
②以KSCN为指示剂,用标准KI溶液滴定未知的Fe3+,滴定终点的实验现象为:溶液的血红色刚好退去,且半分钟内颜色无变化。
③由表可知,第二次滴定数据是错误的,不能用来算平均体积,故舍去。滴定消耗KI溶液的平均体积为30.00mL,根据:
I- ~ Fe3+
1mol 56g
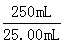 ×0.5000×30.00×10-3mol m(Fe3+) ×0.5000×30.00×10-3mol m(Fe3+)
m(Fe3+)=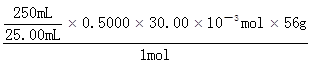 =8.40g =8.40g
所以w(Fe)=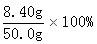 =16.8%。 =16.8%。
④滴定过慢,KI溶液被空气氧化,消耗KI溶液的体积增大,故滴定结果偏大;发生反应的离子方程式为:4H++4I-+O2=2I2+2H2O。
【猜题理由】本题来源于真实的化工工艺,废物中资源的回收、综合利用。该试题起点高、结构新颖,工
业背景的题材多、提问灵活,该类题符合考纲“能够从试题提供的新信息中,准确地提取实质性内容,考
查学生知识迁移的能力”。 将元素化合物知识放置在真实的化学工业环境中,从而达到考查同学们的综
合分析问题的能力以及将新信息和已有信息整合,重组为新信息块的能力。是新课改区高考题的一大“亮
点”。已成为课改省份必考题型之一。
【声明】本文属本人原创作品,本文著作权授予“北京凤凰学易科技有限公司”独家所有,本人拥有署名权。
本题难度:困难
|