微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水的沸点是100 ℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7 ℃,引起这种差异的主要原因是( )
A.氢键
B.共价键
C.范德华力
D.相对分子质量
参考答案:A
本题解析:水和硫化氢都为分子晶体,但是水分子中有氢键,所以沸点很高。
本题难度:简单
2、选择题 下列两组热化学方程式中,有关△H的比较正确的是(???)
①? CH4g)+2O2(g) ====CO2(g)+2H2O(g);△H1
CH4g)+2O2(g) ====CO2(g)+2H2O(l);△H2
②? NaOH(aq) +H2SO4(浓)="===" Na2SO4(aq) +H2O(l) ;△H3
NaOH(aq) + CH3COOH (aq)="===" CH3COONa (aq) +H2O(l) ;△H4
A.△H1>△H2;△H3>△H4
B.△H1>△H2;△H3<△H4
C.△H1=△H2;△H3<△H4
D.△H1<△H2;△H3>△H4
参考答案:B
本题解析:(中难)本题考查有关燃烧热中和热的计算,由于H2O(g)H2O(l)要放出热量,所以等物质的量的CH4g)燃烧,生成液态水时放出热量的数值(绝对值)要比生成气态水时大。等物质的量的NaOH与稀醋酸、浓H2SO4恰好反应生成等物质的量的水,若不考虑物质的溶解热和弱电解质电离吸热,应放出相同的热量。但在实际反应中。浓H2SO4溶于水时放热,使其总放出的热量增多;醋酸是弱酸,部分CH3COOH分子电离过程中要吸热,故中和时放热较少。放热越多,△H的值的绝对值越大,△H实际值越小。
本题难度:一般
3、选择题 下列物质中含有非极性键的化合物是
A.NaOH
B.Na2O2
C.Cl2
D.CO2
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。所以A中含有离子键和极性键,B中含有离子键和非极性键,C中含有非极性键,但氯气是单质,D中含有极性键。答案选B。
本题难度:简单
4、选择题 已知下列反应的热化学方程式:
① C(金刚石,s) + O2(g) === CO2(g) ΔH1
② C(石墨,s) + O2(g) === CO2(g) ΔH2
③ C(石墨,s) === C(金刚石,s) ΔH3=1.9 kJ/mol
则下列说法正确的是
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
参考答案:A
本题解析:
试题分析:A.石墨转化为金刚石△H3=1.9kJ/mol,吸热为正,为吸热反应,A正确; B.石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,B错误;C.根据盖斯定律,③=②-①,△H3=△H2-△H1,C错误;D.石墨在一定条件下转化成金刚石是吸热反应,说明石墨的能量低于金刚石的能量,①式放出的能量比②低,放热为负值,△H1<△H2,D错误;选A。
考点:考查吸热反应与放热反应。
本题难度:一般
5、选择题 2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l)若实验测得反应放出的热量为3695 kJ。则原混合气体中H2与CH4的物质的量之比是
A.1∶1
B.1∶3
C.1∶4
D.2∶3
参考答案:B
本题解析:
试题解析:H2与CH4的混合气体112L,n=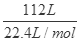 =5mol,设H2与CH4的物质的量分别为x、y,
=5mol,设H2与CH4的物质的量分别为x、y,
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1,
2 571.6kJ
x 285.8x
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ?mol-1,
1 890kJ
y 890ykJ
则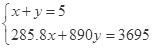 ,解得x=1.25mol,y=3.75mol,原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选B.
,解得x=1.25mol,y=3.75mol,原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选B.
考点:有关反应热的计算
本题难度:一般