微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光? B.焰色反应 C.原子光谱?? D.燃烧放热? E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)?
②在a:苯? b:CH3OH? c:HCHO? d:CS2? e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+??????? _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:

(5) A、B均为短周期金属元素。依据下表数据和已学知识,
电离能/KJ·mol-1
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式: _______________________________________________。
参考答案:(1)D?、 E?(2分,漏选得1分,有错选不得分)
本题解析:
试题分析:(1)燃烧放热、石墨导电都与电子跃迁无关,故本题的答案选择DE;(2)A、B两种短周期元素,A是原子半径最小的元素,故A为H元素;B原子最外层电子数是次外层的两倍,所以B为C;某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子苯,所以其中含有12个σ键;(3)①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有Cu 、K;②在a:苯? b:CH3OH? c:HCHO? d:CS2? e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子b和e,而a和c中碳原子是采用
本题难度:一般
2、选择题 X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大.Z和N可以形成ZN2型化合物.下列有关说法正确的是( )
A.X与Y只能形成一种化合物
B.最高价氧化物对应水化物的碱性:Y>Z
C.气态氢化物的热稳定性:M>N
D.单质的氧化性:X<M
参考答案:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数
本题解析:
本题难度:简单
3、选择题 下列各组物质中,都是由极性键构成的极性分子的一组是
[???? ]
A、CCl4和Br2
B、NH3和H2O
C、H2S和CS2
D、CO2和HCl
参考答案:B
本题解析:
本题难度:简单
4、填空题 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在。
请回答下列问题:
(1)X2分子中σ键和π键数目比是?????????。
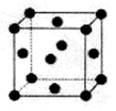
(2)R的晶胞结构如右图所示,该晶胞中所含的原子个数是???。
(3)下列有关X、Y、W的说法正确的是????。
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3-中X的杂化轨道类型为sp3 杂化
④W属于d区的元素
(4) 将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是??????????????????????????????。
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是???????????????????????????。
参考答案:(1)1:2??(2)4??(3)②④?(4)4NH3+2C
本题解析:
试题分析:X的基态原子核外有7种不同运动状态的电子,即原子核外电子是7个,是N元素;Y原子最外层有2对成对电子,是第VIA族元素,结合它元素的后面特点,只能是O;Z的原子序数为Y的原子序数的2倍,是S;W3+的基态离子3d轨道为半充满状态,说明W的外围电子为3d64s2,是Fe元素;R的氢氧化物悬浊液可用于检验葡萄糖的存在,R是Cu元素。
(1)N2分子结构式是N≡N,故分子中有1个σ键和2个π键。
(2)Cu晶胞中所含的原子个数是顶角为8个、面心为6个,平均原子数目是8×![]()
本题难度:一般
5、选择题 下列性质中,可以证明某化合物内一定存在离子键的是[???? ]
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
参考答案:D
本题解析:
本题难度:一般
|