微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关金属及其化合物性质叙述正确的是
A.铁在纯氧气中燃烧,生成最高价氧化物
B.铜与硫反应,生成黑色的 CuS
CuS
C.相同质量的铝分别与足量的盐酸和氢氧化钠溶液反应,生成氢气的量相同
D.Na在氧气中燃烧主要生成Na?2O
参考答案:C
本题解析:略
本题难度:一般
2、实验题 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
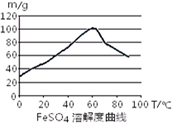
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
A.浓硫酸
B.10moL/L硫酸
C.3moL/L硫酸
D.任意浓度硫酸;
温度宜控制在______;加热的同时需适当补充水,原因是??????????。反应中应保持n(Fe)/n(H2SO4)?????????1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是? 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
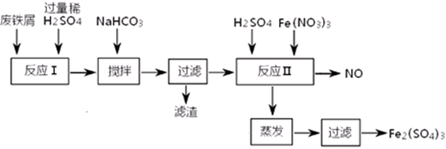
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
?
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
参考答案:
(1)倾析???
(2)C ; 60℃左右;防
本题解析:
试题分析:
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法。
(2)在室温下,Fe在浓硫酸中会发生钝化现象。在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水。不能得到硫酸亚铁。所以要用3moL/L硫酸。选项为C。由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右。为防止硫酸亚铁晶体析出,加热的同时需适当补充水。为了防止在加热的过程中
本题难度:困难
3、选择题 使铁片和银片保持接触并放入相同物质的量浓度的下列物质的溶液中,反应一段时间后,溶液质量减小的是(??? )
A.氯化铝
B.硫酸铜
C.硝酸钠
D.稀硫酸
参考答案:B
本题解析:形成FeAg原电池,Fe被腐蚀,将Cu置换出来,溶液质量减轻,B项可选;将H2置换出来,溶液质量增重,A、C两项发生吸氧腐蚀,溶液质量增重。
本题难度:简单
4、选择题 化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是
A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色
B.向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色
C.向Fe(NO3) 2溶液中滴加稀硫酸,能使溶液变为棕黄色 2溶液中滴加稀硫酸,能使溶液变为棕黄色
D.将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (8分)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有??????????和?????????(写化学式)。
(2)完全反应后,所得溶液中的溶质是????????????????????????。
(3)写出反应过程其中1个化学反应的化学方程式:???????????????????????????。
(4)整个反应过程中,被还原的HNO3总的物质的量是??????????mol。
参考答案:(共8分)(1)(2分)NO;NO2????????????
本题解析:
试题分析:(1)由于随着反应的进行,硝酸的浓度会逐渐降低,所以生成的气体由最初的NO2,逐渐过渡到NO,即生成的气体是NO2和NO的混合气。
(2)铜被硝酸氧化生成硝酸铜,且铜是过量的,所以完全反应后,所得溶液中的溶质是硝酸铜。
(3)有关反应的化学方程式是Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O。
(4)硝酸的还原产物是NO和NO2,所以根据氮原子守恒可知,整个反应过程中,被还原的HNO
本题难度:简单
|