微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中进行反应:2SO2(g)+O2(g) 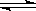 ?2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
?2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
A.O2为0.15mol?L-1
B.SO2为0.25mol?L-1
C.SO3为0.4mol?L-1
D.O2、SO3的浓度相等
参考答案:C
本题解析:考查可逆反应的特点。根据原子守恒可知,容器内硫原子的总的物质的量浓度是0.4mol/L,又因为反应是可逆反应,所以三氧化硫的浓度不可能是0.4mol/L,选项C是错误的,其余选项都是正确的,所以答案选C。
本题难度:一般
2、实验题 为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;??
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为??????????????????????????????。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
???????????????????????????????????????????????????????????????????????????。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+?????猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
实验操作
| 现象和结论
|
步骤一:
| 若产生暗蓝色沉淀,则??????????????????。
|
步骤二:
| 若乙醚层呈红色,则??????????。
?
②写出实验操作“步骤一”中的反应离子方程式:????????????????????????。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为????????mol/L。
参考答案:(共14分)(1)2Fe3+ + 2I-=2Fe2+ + I
本题解析:
试题分析:(1)铁离子具有氧化性,能把碘离子氧化生成单质碘,反应的离子方程式是2Fe3+ + 2I-=2Fe2+ + I2。探究活动Ⅱ是用四氯化碳萃取单质碘,因此正确的操作是将分液漏斗放在铁架台上,静置。待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下。
(2)①根据步骤1中实验现象是产生暗蓝色沉淀,这说明加入的试剂是K4[Fe(CN)6](亚铁氰化钾)溶液,所以步骤1是取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液。若产生暗蓝色沉淀,则猜想一不成立;根据步骤2中实验现象是乙醚层呈红色,这说明加入的试剂是乙醚,则步骤2的操作是取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层。若乙醚层呈红色,则猜想二成立。
②根据以上分析可知,实验操作“步骤一”中的反应离子方程式是4Fe3+ +3[Fe(CN)6]4—=Fe4[Fe(CN)6]3↓。
(3)根据方程式2Fe3+ + 2I-=2Fe2+ + I2可知
Fe3+~~~~~I-
1mol??????? 1mol
0.0250Lx??? cmol/L×0.001VL
解得x=0.04cVmol/L
本题难度:困难
3、选择题 下列说法正确的是:
A.只要是有气体参加或生成的化学反应,化学平衡都会受压强的影响
B.化学平衡向正反应方向移动,反应物的转化率不一定增大
C.增大反应物的浓度可以使反应物活化分子百分数增多,从而加快化学反应速率
D.化学平  衡发生移动,则化学平衡常数一定也发生相应的变化 衡发生移动,则化学平衡常数一定也发生相应的变化
参考答案:B
本题解析:略
本题难度:一般
4、选择题 在一定条件下,某密闭容器中发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g)+Q;达到化学平衡时,SO2、O2和SO3的物质的量之比3:2:4。其它条件不变,升高温度达到新的化学平衡时,二氧化硫为1.4mol,O2为0.9mol,则此时SO3的物质的量为(??? )
A.1.4mol
B.1.6mol
C.1.8mol
D.2.0mol
参考答案:A
本题解析:升高温度平衡向吸热反应方向即逆向移动
_?????? 2SO2??????+????? O2????==?? 2SO3
平1n:???
△n:???? 2n?????????????? n????????? 2n
平2n:?? 1.4mol???????? 0.9mol
所以: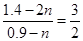 ,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol ,可求出n=0.1。则原先平衡时SO2为1.2mol,SO3为1.6mol,新平衡时SO3为1.4mol
本题难度:一般
5、选择题 在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
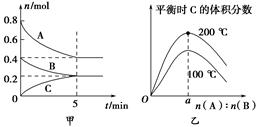
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2 zC(g)的ΔH<0,且a=2
参考答案:B
本题解析:
试题分析:A、200 ℃时,反应从开始到平衡B的浓度减少0.2mol/2L=0.1mol/L,所以平均速率v(B)=0.1mol/L/5min=0.02mol·L-1·min-1,错误;B、根据图中数据可知该反应的化学方程式为2A(g)+B(g) C(g)。200℃时,A、B、C的平衡浓度分别是0.2mol/L、0.1mol/L、0.1mol/L,根据化学平衡常数的定义得K=0.1mol/L/0.1mol/L×(0.2mol/L)2="25" L2/mol2,正确;C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,错误;D、由图乙可知温度升高,C的体积分数增大,说明升高温度,平衡正向移动,正向为吸热反应,ΔH>0,a值不确定,错误,答案选B。 C(g)。200℃时,A、B、C的平衡浓度分别是0.2mol/L、0.1mol/L、0.1mol/L,根据化学平衡常数的定义得K=0.1mol/L/0.1mol/L×(0.2mol/L)2="25" L2/mol2,正确;C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,错误;D、由图乙可知温度升高,C的体积分数增大,说明升高温度,平衡正向移动,正向为吸热反应,ΔH>0,a值不确定,错误,答案选B。
本题难度:一般
|