微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(填化学式) 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式 、 。
参考答案:(1)Na2CO3(2)H++OH-=H2O &#
本题解析:
试题分析:碳酸钠因其水溶液显现碱性而俗称纯碱。在物质的分类上属于盐。酸都电离产生氢离子H+,氢氧化钠电离产生OH-, Na2CO3电离产生CO32-,故发生上述两个离子反应,离子方程式略。
考点:考查化学物质与俗称及离子方程式等知识。
本题难度:一般
2、填空题 (12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:

请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 。
(2)该方案中选用熟石灰调节pH,理由是 、 ,在调节pH时,若pH过大或过小都会造成 的利用率降低。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 _。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
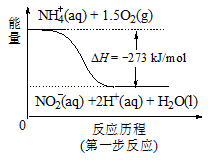
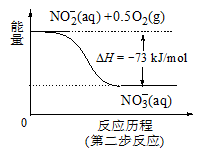
试写出1 mol NH4+ (aq)全部氧化成NO3-(aq)的热化学方程式是 。
参考答案:(1)10Al + 6NO3- + 18H2O==10Al(
本题解析:
试题分析:(1)根据题意,在含有NO3-的碱性溶液中加入铝粉,会发生氧化还原反应,结合电子守恒、原子守恒及电荷守恒,可得反应的离子方程式为10Al + 6NO3- + 18H2O==10Al(OH)3 + 3N2↑+ 6OH-;(2)该方案中选用熟石灰调节pH,理由是引入的Ca2+对人体无害,而且熟石灰的来源丰富、价格便宜;在调节pH时,若pH过大或过小都会造成Al发生反应产生氢气,导致Al的利用率降低。(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,说明氧化产物是水,还原产物是N2,则催化还原法的离子方程式为5H2 + 2NO3 N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
考点:考查含NO3-的污水的处理方法的离子方程式的书写、化学试剂的选择、热化学方程式的书写的知识。
本题难度:困难
3、填空题 (16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
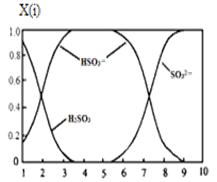
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)

参考答案:(1)SO2+OH-=HSO3-
(2)①c(Na+)
本题解析:
试题分析:(1)根据流程图可知,二氧化硫与NO的混合气体与氢氧化钠溶液反应主要生成亚硫酸氢钠,所以装置Ⅰ中的主要离子方程式为SO2+OH-=HSO3-;
(2)①由图可知,pH=8时溶液中主要的阴离子是亚硫酸根离子,说明二氧化硫与氢氧化钠溶液反应主要生成亚硫酸钠,其次还有少量的亚硫酸氢钠,则溶液中离子浓度的大小关系是c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,溶液的酸性增强,因为亚硫酸氢根离子存在电离平衡HSO3-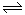 H++ SO32-,钙离子与亚硫酸根离子结合为亚硫酸钙沉淀,促进亚硫酸氢根离子的电离,氢离子浓度增大,pH减小;
H++ SO32-,钙离子与亚硫酸根离子结合为亚硫酸钙沉淀,促进亚硫酸氢根离子的电离,氢离子浓度增大,pH减小;
(3)装置II是Ce4+与NO的反应,将NO氧化为硝酸根离子和亚硝酸根离子,自身被还原为Ce3+,离子方程式是NO+3Ce4++2H2O=NO3-+ 3Ce3++4 H+, NO+Ce4++H2O=NO2-+ Ce3++2 H+;
(4)装置Ⅲ还可以使Ce4+再生,则Ce3+被氧化为Ce4+,阳极发生氧化反应,所以Ce4+从电解槽的a口流出;阴极发生还原反应,根据流程图可知,HSO3-得到电子生成S2O42-,则电极反应式是2HSO3-+2e-+2H+= S2O42-+2H2O;
(5)NO2-与氨气、氧气反应生成硝酸铵,则N元素被氧化,化合价从+3价升高到+5价,1m3的溶液中的NO2-的物质的量是1000L×ag/L/46g/mol=1000a/46mol,失去电子的物质的量是1000a/46×2mol=,根据得失电子守恒,则需要氧气在标准状况下的体积是1000a/23mol/4×22.4L/mol=5600a/23L。
考点:考查电解质溶液中离子浓度的关系,对流程的分析,氧化还原反应的分析判断
本题难度:困难
4、填空题 (10分)填写下列空白:
(1)NaHSO4在熔融状态下的的电离方程式为: ;
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为 ;
(3)向NaHCO3溶液中加过量的Ba(OH)2溶液 ,其离子方程式为 ___ ___ __
(4)向Ba(OH) 2溶液中通入过量的CO2,其离子方程式为 __________ _____
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)______________________________________。
参考答案:(1) NaHSO4 =
本题解析:
试题分析:(1)熔融状态下,共价键不被破坏,NaHSO4在熔融状态下的的电离方程式为:NaHSO4 = Na+ + HSO4-;(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水,其离子方程式为Ba2+ + SO42- + 2OH-- +2H+ = Ba SO4↓ + 2H2O;(3)向NaHCO3溶液中加过量的Ba(OH)2溶液生成碳酸钡、氢氧化钠和水 ,其离子方程式为HCO3-- + Ba2+ + OH-- = H2O+BaCO3 ↓ ;(4)向Ba(OH) 2溶液中通入过量的CO2,生成碳酸氢钡,其离子方程式为OH- + CO2=HCO3-;(5)向酸性高锰酸钾溶液中通入二氧化硫气体,生成硫酸锰、硫酸钾、和硫酸,离子方程式为5SO2 +2MnO4- + 2H2O =2Mn2+ + 5SO42- + 4H+。
考点:考查离子方程式的书写。
本题难度:一般
5、选择题 下列离子方程式正确的是
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH-+ 2HCO3- = CaCO3↓+CO32-+2H2O
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
参考答案:B
本题解析:
试题分析:向澄清石灰水中加入等物质的量的NaHCO3溶液,氢氧根离子有剩余,故离子反应方程式为Ca2++OH-+ HCO3- = CaCO3↓+H2O,A错误;向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全,此时氢氧根离子与氢离子反应生成水,另外还与铵根离子反应生成一水合氨,故B正确;氢氧化铁溶于氢碘酸中不但发生酸碱中和反应,铁离子还与碘离子发生氧化还原反应,C错误;明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值,即使铝离子恰好完全生成氢氧化铝沉淀时,D错误,答案选B。
考点:离子方程式的书写
本题难度:困难