微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
参考答案:①2H++ SO42—+ Ba2+ + 2OH—=BaSO4
本题解析:
试题分析:n(H+)="0.1×0.1×2=0.02(" mol),n(SO42-)="0.1×0.1" +0.1×0.1 ="0.02(" mol);n(Ba2+)="0.2×0.05=0.01(" mol),n (OH-)="0.2×0.05×2=0.02(" mol),所以反应实质是H2SO4和Ba(OH)2溶液反应。离子方程式是:2H++ SO42—+ Ba2+ + 2OH—=Ba SO4 ↓+2 H2O。反应后的溶液为Na2SO4溶液其浓度为:C(Na2SO4)=n
本题难度:一般
2、填空题 (12分)某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
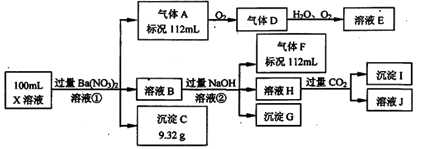
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
(2)用离子方程表达下列反应:
①中生成气体A:___________ 。②中生成溶液H:____________ 。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为_______来源:91考试网 www.91exAm.org____mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
参考答案:(每空2分,共12分)(1) Fe3+、Cl-<
本题解析:
试题分析:由于CO32-、SO32-会与H+发生反应,所以在强酸性溶液X中不可能含有CO32-、SO32-;向100ml的该溶液中加入过量的Ba(NO3)2溶液,产生白色沉淀C是BaSO4,n(BaSO4)=9.32g÷233g/mol=0.04mol;说明含有SO42-,由于SO42-与Ba2+会发生沉淀反应不能大量共存,所以不含Ba2+;向100ml的该溶液中加入过量的Ba(NO3)2溶液,产生气体A112ml,说明在溶液中含有还原性的离子Fe2+,由于在酸性条件下,Fe2+、H+、NO3-会发生反应不能大量共存,所以不含NO3-;反应产生的气体A是NO,根据电子转移守恒可得3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,n(NO)=0.112L÷22.4L/mol=0.005mol;则n(Fe2+)=0.015mol;NO与氧气发生反应变为D:NO2,NO2和水发生反应 产生E:HNO3;向溶液B中加入NaOH溶液,加热反应产生的气体F是NH3;则在原溶液中含有NH4+,n(NH4+)= 0.112L÷22.4L/mol =0.005mol;由于在原溶液中含有Fe2+被硝酸氧化形成Fe3+,则产生沉淀G含有Fe(OH)3;向所得的溶液中通入过量的CO2,产生沉淀I是Al(OH)3,在溶液H中含有AlO2-,则在原溶液中含有Al3+;Al3+变为AlO2-的方程式是:Al3+ +4OH-=AlO2-+2H2O。溶液J中含有NaHCO3、Ba(HCO3)2。终上所述可知在原溶液中一定含有的离子是:Al3+、NH4+、Fe2+、SO42-,一定不含有的离子是NO3-、CO32-、SO32-、Ba2+,不能确定是否存在的离子是Cl-、Fe3+;(2)①中生成气体A的离子方程是3Fe2++4H++NO3-=3Fe3++ NO↑+ 2H2O ;②中生成溶液H的离子方程式是Al3+ +4OH-=AlO2-+2H2O;(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,n(H+)=2mol/L×0.01L=0.02mol;n(Fe3+)+n(Al3+)="0.03" mol, n(Al3+)=n(Al(OH)3)= 0.005mol,所以在溶液B中含有n(Fe3+)="0.025" mol,由于发生反应3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,n(NO)=0.112L÷22.4L/mol=0.005mol;则在原溶液中含有Fe2+的物质的量是:n(Fe2+)=0.015mol;则原溶液中含有Fe3+的物质的量是0.025 mol -0.015mol=0.01mol,则c(Fe2+)=n(Fe2+)÷V=0.015mol÷0.1L=0.15mol/L;c(Fe3+)=n(Fe3+)÷V=0.01mol÷0.1L=0.1mol/L;根据电荷守恒可确定在溶液中含有的Cl-的物质的量。1×n(Cl-)+2×n(SO42-) =1×n(H+)+ 3×n(Al3+)+ 3×n(Fe3+)+ 2×n(Fe2+)+ 1×n(NH4+)。n(Cl-)+2×0.04mol=0.02mol+3×0.005mol+3×0.01mol+2×0.015mol+0.005mol,解得n(Cl-)= 0.02mol,所以c(Cl-)=0.02mol÷0.1L=0.2mol/L。
考点:考查溶液成分的确定、离子共存、离子方程式的书写的知识。
本题难度:困难
3、填空题 (8分)根据所学知识,完成下列要求。
(1)Fe2(SO4)3(写出电离方程式): 。
(2)H++OH-
参考答案:
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.NaHSO3溶液与NaOH溶液反应:H++OH-=H2O
B.少量二氧化碳通入足量的NaOH溶液中:CO2+OH-=HCO3-
C.Fe与盐酸反应产生氢气:2Fe+6H+=2Fe3++3H2↑
D.氨水与醋酸溶液混合:NH3·H2O+CH3COOH=NH4++CH3COO-+H2O
参考答案:D
本题解析:
试题分析:A、NaHSO3溶液与NaOH溶液反应,离子方程式为H SO3-+OH-= SO32-+H2O,A错误;B、少量二氧化碳通入足量的NaOH溶液中,离子方程式为CO2+2OH-=CO32-+H2O,B错误;C、Fe与盐酸反应产生氢气,离子方程式为Fe+2H+=Fe2++H2↑,C错误;D、氨水与醋酸溶液混合,离子方程式为NH3·H2O+CH3COOH=NH4++CH3COO-+H2O,D正确,答案选D。
考点:考查离子方程式的正误判断
本题难度:困难
5、填空题 (12分)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。

(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________ 。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
参考答案:(1)蒸馏法(或电渗析法、离子交换法) (2)0.00085
本题解析:
试题分析:(1)海水淡化的方法有多种,比如蒸馏法或电渗析法或离子交换法等。
(2)海水中溴元素(以Br-表示)的浓度0.068g/L,则物质的量浓度为(0.068÷80)=0.00085mol/L;
(3)将低浓度的含Br2溶液还原为Br-,再将Br-氧化又得到Br2,其目的为富集溴元素;
(4)用SO2水溶液吸收Br2,有关反应的离子方程式为Br2+SO2+2H2O===4H++SO42-+2Br-;
(5)Br2的沸点为59 ℃,蒸馏时加热方法最好用水浴加热;Br2腐蚀橡胶,所以蒸馏装置中仪器连接均不能用橡胶塞和橡胶管。
考点:考查海水提取食盐、提溴的操作。
本题难度:一般