微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H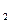 O外,还有H
O外,还有H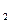 O
O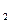 ;碳元素的氢化物除CH
;碳元素的氢化物除CH 外,还有C
外,还有C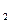 H
H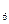 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N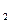 H
H 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为?????????。
(2)该系列中的N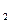 H
H 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N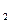 H
H 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:???????????????????。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:???????????????????。
(3)该系列物中的NH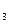 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为:
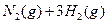 ?
? ?
?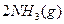 ???
???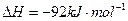
I.在一定温度下,将1.5molN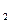 和6 molH
和6 molH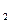 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为???????kJ.
H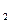 的转化率=???????。
的转化率=???????。
该温度下合成氨反应的平衡常数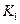 =???????(只列数字表达式)
=???????(只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN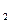 、bmolH
、bmolH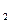 、cmolNH
、cmolNH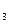 ,平衡时NH
,平衡时NH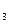 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量???????(填字母代号)
A.一定相等
B.前者一定小于后者
C.前者等于或小于后者
D.前者等于或大于后者
I和II合成氨的平衡常数分别为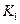 和
和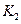 ,同
,同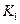 ???
???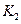 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)
欲使开始时反应正向进行,a的取值范围为 ???????。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、选择题 一定温度下,下列叙述是可逆反应A(g)+3B(g)?2C(g)在定容密闭容器中达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内amol?A生成,同时生成3amolB;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化.
A.②⑤
B.①③④⑤
C.②⑥⑦⑧
D.⑤⑥⑧
参考答案:①C的生成速率与C的分解速率相等,即正逆反应速率相等,达到平
本题解析:
本题难度:简单
3、选择题 在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)

3C(g),只有反应到达平衡时才具有的状态是( )
A.各物质的浓度之比为2:3:3
B.混合物中各物质的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化
D.υ(A):υ(B):υ(C)=2:3:3
参考答案:A、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程
本题解析:
本题难度:简单
4、选择题 关于可逆反应达到平衡状态的说法错误的是( )
A.达平衡时正、逆反应速率相等
B.是动态平衡
C.各组分的含量不随时间而变化
D.外界条件不能改变平衡
参考答案:A、正、逆反应速率相等是化学平衡的标志,故A正确;
B
本题解析:
本题难度:一般
5、选择题 一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(???? )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(???? )
A.若升高温度,X的体积分数增大,则正反应为吸热反
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.以X浓度变化表示的反应速率为0.001 mol/(L·s)
参考答案:D
本题解析:
试题分析:反应2X(g)+Y(g) Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;
Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;
本题难度:一般