微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
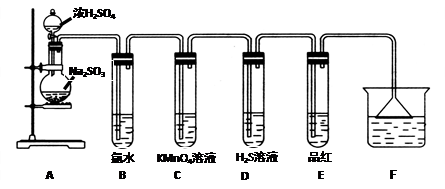
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是????????、???????????;
(2)反应后,装置B中发生的现象是??????????????????,反应的离子方程式为????????????????????;装置C中的现象是???????????????,表现了SO2的????????????;装置D中现象是?????????,发生反应的化学方程式为?????????????????;
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象??????????????????????????????????????????????。
(4)F装置的作用是?????????????,漏斗的作用是??????????。
参考答案:(14分)(1)分液漏斗、圆底烧瓶
(2)溶液褪色,S
本题解析:
试题分析:本实验的目的是探究二氧化硫的性质,A装置是制备二氧化硫,用圆底烧瓶和分液漏斗分别盛放固体及液体;B装置是验证二氧化硫的还原性,与氯气反应生成盐酸和硫酸,现象会溶液褪色,离子方程式为SO2+Cl2+2H2O = 4H++2Cl-+SO42-;C装置也是验证二氧化硫的还原性,紫色褪去,说明发生反应;D装置是检验二氧化硫的氧化性,有黄色沉淀生成,说明发生反应2H2S+SO2=3S+2H2O;E装置是检验二氧化硫的漂白性,为了检验漂白的暂时性,将试管E在酒精灯上加热,溶液恢复红色;F装置是用氢氧
本题难度:一般
2、实验题 (6分)下图为浓硫酸与铜反应的实验装置图。

(1)浓硫酸与铜反应的化学方程式为????????????????????????????????????????。
(2)实验中,当产生的气体进入盛有品红溶液的仪器b中时,品红溶液将??????????????,原因是????????????????????????。
参考答案:(6分)Cu + 2H2SO4(浓) 本题解析:浓硫酸具有强氧化性,可将铜氧化为硫酸铜,而部分硫酸被还原为二氧化硫:Cu + 2H2SO4(浓)
本题解析:浓硫酸具有强氧化性,可将铜氧化为硫酸铜,而部分硫酸被还原为二氧化硫:Cu + 2H2SO4(浓) ?CuSO4 +SO2 ↑+2H2O;
?CuSO4 +SO2 ↑+2H2O;
由于二氧化硫具有漂白性,可与品红结合生成无色化合物,故可使品红试液褪色。
本题难度:一般
3、选择题 某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
A.铜与浓硫酸反应所得白色固体不是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中一定含有元素Cu和S
参考答案:D
本题解析:A项,因倒入盛有少量水的烧杯中,发现所得溶液为蓝色,说明白色固体是CuSO4;B项,因倒入烧杯时含有少量硫酸,所以加BaCl2溶液后所得白色沉淀是BaSO4;C项,CuO能与硫酸反应而溶解,所以黑色固体不是CuO;D项,加硝酸后黑色物质溶解溶液呈蓝色,且加BaCl2溶液后有白色沉淀生成,所以黑色物质一定含有元素Cu和S。
本题难度:一般
4、选择题 接触法制硫酸的生产过程中,下列措施能提高硫酸的产率的是()
A.控制接触室内的温度在450℃左右
B.沸腾炉中通入过量空气
C.对炉气进行除尘、洗涤、干燥处理
D.接触室中用V2O5作催化剂
参考答案:B
本题解析:通入过量空气,可以使矿石燃烧充分而提高硫酸的产率,B符合题意;对炉气进行除尘、洗涤、干燥处理的目的是防止催化剂中毒,不能提高硫酸的产率,C不符合题意;接触室中用V2O5作催化剂和控制接触室内的温度在450 ℃左右,都只能提高化学反应的速率,不能提高硫酸的产率,A、D不符合题意。
本题难度:简单
5、选择题 向100mL18mol/L的H2SO4溶液中加入足量的铁片加热。充分反应后,产生的气体在标准状况下的体积为(提示:2Fe+6H2SO4(浓)  Fe2(SO4)3+SO2↑+6H2O)。
Fe2(SO4)3+SO2↑+6H2O)。
A.小于20. 16 L
B.等于20. 16 L
C.介于20. 16 L和40. 32 L之间
D.等于40. 32 L
参考答案:C
本题解析:
试题分析:足量的铁和浓硫酸反应,随反应进行,浓硫酸浓度会降低。采用极限法,若全部生成SO2,则气体体积为20.16L,若全部生成H2,则气体体积为40.16L,所以C正确。
本题难度:一般