微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以下是有关SO2、Cl2的性质实验。
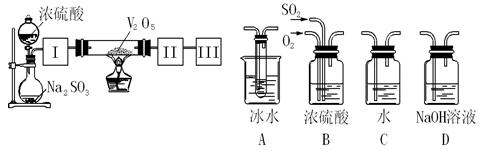
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
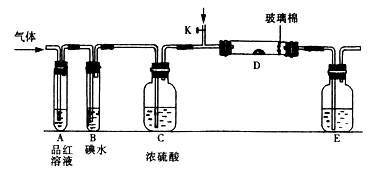
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同????????(填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为?????????????????????????????????????????。
②SO2通入B中,碘水褪色,则该反应的离子方程式为???????????????????????????。
③E中盛有______________溶液。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)???????,则可以看到白色沉淀产生。
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式????????????????????????????。?
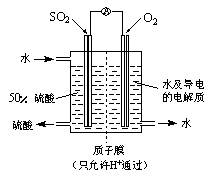
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
通入SO2的电极为_________极,其电极反应式为:
???????????????????????????????????????????。
电池的总反应式为:
???????????????????????????????????????????。
参考答案:
(1) ①相同,??? Cu粉红热,并产生棕黄色烟?
本题解析:
(1)①由于SO2和Cl2都可以使品红溶液褪色,所以A中分别通入SO2和Cl2,观察到的现象是相同的。若D中盛铜粉,通入足量的Cl2,D中发生的反应是:Cu+ Cl2= CuCl2,现象是Cu粉红热,并产生棕黄色烟。若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2,则发生SO2的催化氧化,反应方程式为2SO2 + O2 本题难度:一般
本题难度:一般
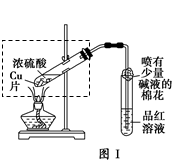
2、实验题 某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。
 ???
???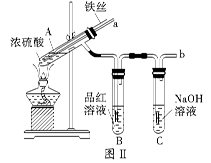
请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
步骤
| 所选试剂
| 现象及结论
|
1
| ?
| ?
|
2
| ?
| ?
|
3
| ?
| ?
?
参考答案:(共12分)
(1)Cu+2H2SO4(浓)
本题解析:
试题分析:
(2)铁丝可进可出,便于控制反应的进行。
(3)铁丝可进出,起到搅拌的作用,玻璃导管没有搅拌作用。A错,选BC。
(4) ①若硫酸过量,得Fe3+;铁过量,得Fe2+;若过量一部分,同时含有Fe2+和Fe3+。
②Fe3+和KSCN溶液反应,溶液变红;Fe2+遇KSCN溶液不变红,加KMnO4溶液后,变红。
本题难度:困难
3、实验题 实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为????????????????????????????????????????????????????????。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ??????????,装置Ⅱ??????????,装置Ⅲ??????????。
(3)开始进行实验时,首先应进行的操作是?????????????????????????????。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会???????????(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是???????????????????????????????????????????????????????????。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是????????????(用含字母的代数表示)。
参考答案:(1)2SO2(g)+O2(g)  本题解析: 本题解析:
试题分析:(1)ΔH与反应物的物质的量有关,所以热化学方程式中各物质的系数必须与ΔH相对应,如果系数加倍,则ΔH也要加倍。??
(2)图中Ⅰ装置的作用一是干燥气体;二是使SO2和O2均匀混合,所以选B、Ⅱ装置的作用是冷却SO3,使其变成液体,所以选A,、Ⅲ装置的作用除去尾气SO2,所以选D (3分)??????
(3)一般说来,无论采用那种装置制取气体,在成套装置组装完毕装入反应物之前,必须检查装置的气密性,以确保实验的顺利进行。(1分)
(4)因为2SO2(g)+O2(g) <
本题难度:困难
4、选择题 实验室采购了部分化学药品。右图是从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是

A.该硫酸的物质的量浓度为9.2mol·L-1
B.1molAl与足量的该硫酸反应产生3g氢气
C.这种硫酸在常温下不能使铁钝化
D.配制200mL2.3mol·L-1的稀硫酸需量取该硫酸25 mL
参考答案:D
本题解析:略
本题难度:简单
5、实验题 (15分)为研究硫酸的性质,研究性学习小组设计以下两个实验。实验一:检查好装置的气密性后,在如图一所示甲的试管中加入足量的Fe合金(含有一定量的C),然后,加入少量浓硫酸。
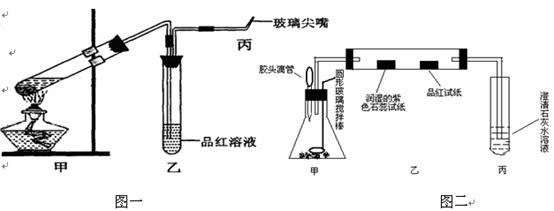
图一?????????????????????????????????????????图二
①.在未点燃酒精灯时,乙中没有明显现象,这是因为________________________???
为处理生成的有毒气体,还应在乙、丙之间接入干燥管,并在其中填充足量的????????。
②.反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
若甲中加入的是纯铁,丙处产生气体的速率没有前者的快,这是因为____________
实验二:
高一必修教材《浓硫酸与蔗糖反应的实验》这个传统实验是在敞口容器中进行,药品用量大,且浓硫酸与蔗糖反应过程中生成大量有毒气体直接排放到空气中,不符合“绿色化学”的新理念;对此实验进行新的设计和改进:取少量的蔗糖置于锥形瓶中加入几滴水,用胶头滴管滴加几滴浓硫酸,通过圆形玻 璃搅拌棒不断搅拌;如上图二所示观察:
①.白色的蔗糖发黄再变黑,这是因为浓硫酸具有?????????????????性;一会儿迅速变成蜂窝状(形似“黑馒头” );写出发生的化学方程式:??????????????????????????????
②.紫色石蕊试纸变红,品红试纸褪色,澄清石灰水出现浑浊,该小组同学认为有二氧化碳生成,你是否赞成此观点;若赞成就不填写;若不赞成,你将如何改进才能证明有二氧化碳生成:????????????????????????????????????????????????????????????????????
③.另一小组将紫色石蕊试纸更换为少许无水硫酸铜,结果没有观察到无水硫酸铜变蓝,证明浓硫酸具有??????????;
参考答案:实验一
①常温下,Fe遇浓硫酸钝化(1分),而C不与浓
本题解析:略
本题难度:一般
|