微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:
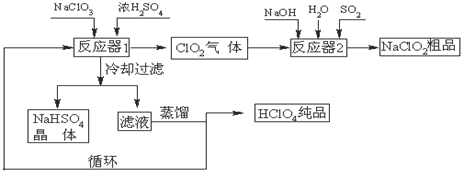
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
参考答案:(每空2分,共12分) (1)溶解度 (2)2Cl
本题解析:
试题分析:(1)在反应器1中,硫酸钠和硫酸反应得到硫酸氢钠。冷却过滤可以得到硫酸氢钠晶体,这说明冷却过滤的目的是降低NaHSO4的溶解度,并分离出NaHSO4晶体。
(2)SO2具有还原性,在碱性溶液中能把ClO2还原为NaClO2,反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)根据反应2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O可知,氯酸钠中氯元素的化合价从+5价降低到+4价,得到1个电子,ClO2是还原产物。亚硫酸钠中S元素的化合价从+4价升高到+6价,失去2个电子,硫酸钠是氧化产物。根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2;
(4)根据题意高氯酸的沸点为90C,沸点比较低,因此可以采用蒸馏滤液的方法得到高氯酸。根据流程图可知现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,因此硫酸可以循环使用。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
2、填空题 (8分)按下列要求各举一例,写出有关化学方程式,并标出电子转移的方向和数目。
(1)氢气还原一种非金属单质______________________
(2)同一种物质中的一种元素被氧化,另一种元素被还原________________
(3)同种元素不同物质间的氧化还原反应__________________________
(4)一种固体非金属单质置换另一种气体非金属单质______________________
参考答案:27、每空2分,共8分。其它符合题意亦可。
(1)
本题解析:
试题分析:(1)氢气还原一种非金属单质,常见反应是H2燃烧,如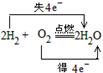
(2)同一种物质中,一种元素氧化另一种元素,反应物只有一种,生成物中有单质生成的分解反应,如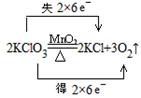
(3)同种元素不同物质间的氧化还原反应,常见的是归中反应,如: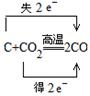
(4)一种固体非金属单质置换另一种气体非金属单质,该反应为置换反应,如
考点:考查氧化还原反应电子转移的表示方法。
本题难度:一般
3、选择题 盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
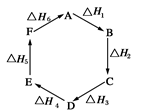
A.A→F,ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
参考答案:B
本题解析:试题分析:从反应图像来看,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6表示从A又回到A,整个过程中没有能量变化,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,B项错误,答案选B。
考点:盖斯定律
点评:化学反应中的能量变化只与反应物和产物的状态有关,与反应的路径无关。
本题难度:困难
4、选择题 电解84.7mL、质量分数为16%的氢氧化钠溶液(密度1.18g·cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨作电极),这是因为
A.溶质增加了3.5g
B.有1mol水被电解
C.在阳极生成2g H2
D.在阳极生成16g O2
参考答案:BD
本题解析:惰性电极电解氢氧化钠溶液,实质是电解水。氢氧化钠不变,所以电解后溶液的质量是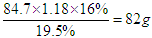 ,所以溶液质量是100g-82g=18g,即被电解的水是18g,所以阳极生成氧气16该,阴极产生氢气2g,答案选BD。
,所以溶液质量是100g-82g=18g,即被电解的水是18g,所以阳极生成氧气16该,阴极产生氢气2g,答案选BD。
本题难度:一般
5、选择题 下列物质中,属于电解质的是
A.铜
B.酒精
C.蔗糖
D.食盐晶体
参考答案:D
本题解析:
试题分析:铜是单质,不是电解质,也不是非电解质。酒精和蔗糖是非电解质,氯化钠是电解质,答案选D。
考点:考查电解质的判断
点评:溶于水或熔融状态下能够自身电离出离子的化合物是电解质,再上述条件下,都不能电离出离子的化合物是非电解质,据此可以判断电解质和非电解质。
本题难度:一般