微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4.
(1)电解时,应以?????????作阴极,电解过程中阴极附近溶液pH将会??????????
(2)阳极反应式为?????????????????(3)总电解反应式为???????????????
参考答案:Fe?增大 MnO42—e=MnO4—?? 2K2MnO4+
本题解析:略
本题难度:一般
2、填空题 (12分)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是??????(填序号)。
A.NiO2
B.Fe
C.Fe(OH)2
D.Ni(OH)2
(2)该电池放电时,正极附近溶液的PH?????(填增大、减小、不变)
(3)充电时该电池阳极的电极反应式???????????
(4)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了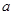 g M,则金属M的相对原子质量为????????????????????????????????????????(用含“
g M,则金属M的相对原子质量为????????????????????????????????????????(用含“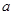 、x”的表达式表示)。?????????????
、x”的表达式表示)。?????????????
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是????????;将电解后的溶液加水稀释至1L,此时溶液的PH=????????。
参考答案:(1) A??? (2) 增大?(3) Ni(OH)2 -2
本题解析:
试题分析:(1)得到电子,化合价较低的反应是还原反应,原电池中正极得到电子,发生还原反应,负极失去电子,发生氧化反应,所以根据总的反应式可知,铁是负极,氧化镍是正极,答案选A。
(2)正极是氧化镍得到电子,生成氢氧化镍,电极反应式是NiO2 + 2H2O -2e-=Ni(OH)2 + 2OH-,所以该电池放电时,正极附近溶液的PH增大。
(3)充电相当于放电的逆反应,所以阳极电极反应式就是原电池中正极反应式的逆反应,即Ni(OH)2 -2e + 2OH- ="=" NiO2 + 2H2
本题难度:一般
3、选择题 下列有关金属腐蚀与防护的说法正确的是
A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.纯银器表面在空气中因电化学腐蚀渐渐变暗
D.金属腐蚀的电化学腐蚀,是利用了原电池原理,但原电池原理不能用于金属防护
参考答案:A
本题解析:因为锌比铁活泼,形成原电池时锌为负极,铁为正极而被保护,称作牺牲阳极的阴极保护法,A项正确;镀锡铁制破损时,因铁比锡活泼,形成原电池时铁作负极,反而加快了铁的腐蚀,B项不正确;纯银能与硫等化合形成硫化物,发生化学腐蚀而变暗,C项不正确;牺牲阳极的阴极保护法也是利用了原电池原理,D项不正确。故答案为A项。
本题难度:简单
4、选择题 如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是
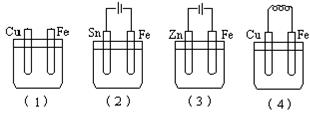
A.(2)(4)(1)(3)
B.(3)(4)(1)(2)
C.(4)(3)(2)(1)
D.(1)(3)(2)(4)
参考答案:B
本题解析:试题分析:金属的腐蚀程度:电解>原电池>化学反应>电极保护。故选B。
考点:金属的腐蚀
点评:本题考查的是金属的腐蚀程度的知识,难度中等,掌握以下规律便很容易解答此类问题,金属的腐蚀程度:电解>原电池>化学反应>电极保护。
本题难度:一般
5、选择题 下列实验正确的是( )
A.
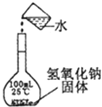
配制一定浓度溶液
B.

制取并收集Cl2
C.
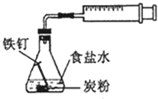
铁的析氢腐蚀
D.
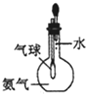
验证氨气易溶于水
参考答案:A.氢氧化钠溶解放出大量的热,冷却后导致所配溶液的体积偏小,
本题解析:
本题难度:一般