微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸
B.氯化亚铁溶液
C.溴苯
D.溴化银
参考答案:B
本题解析:硝酸不稳定,在空气中分解(被还原成NO2)生成NO2,生成的NO2溶于其中显黄色;Fe2+不稳定,在空气中被氧气氧化成Fe3+而显黄色,苯酚在空气中不稳定,氧化后显粉红色,而溴苯无此现象;溴化银不稳定,分解后显黑色,其原因是溴化银被还原生成了银粉末。
本题难度:简单
2、选择题 a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为?????????????????????????????????????????????????????
A.Fe Cu Al Ag Mg
B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe
D.Mg Ag Al Cu Fe
参考答案:C
本题解析:由(1)可判断出a、c是位于金属活动顺序中H前的金属,可能是Fe、Al、Mg中的两种。由(2)可判断出b的金属活动性大于d,即在金属活动性顺序中b在d前。由(3)可确定C为Al。由(4)可确定c、e为Al和Fe,既然c已确定为Al,则可确定e为Fe。回过头来再由(1)可知a为Mg。现在只剩下Cu、Ag两种金属尚未与字母挂联,再由(2)可知b的活动性大于d,则可确定b为Cu,d为Ag。综合以上所述,可确定a、b、c、d、e依次为 Mg、Cu、Al、Ag、Fe。故选项C符合题意。
本题难度:一般
3、填空题 下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。

(1)H的化学式为????????????。
(2)写出I与Fe反应生成G的离子方程式为?????????????????????????????。
(3)反应①的化学方程式为 ????????????????????????????????????????????。
(4)反应②的离子方程式为????????????????????????????????????????????。
参考答案:(1)NaClO
(2)2Fe3++ Fe="3" F
本题解析:
试题解析:(1)由题意可知,①为电解饱和食盐水的实验,A为NaCl,B为H2O,C为NaOH,D为Cl2,则H为NaClO。
(2)I为FeCl3,其和Fe反应的离子方程式为2Fe3++ Fe="3" Fe2+?????
(3)电解饱和食盐水的化学方程式为2NaCl+2H2O===2NaOH+Cl2↑+H2↑
(4)反应②是FeCl3和NaOH的反应,其离子方程式为Fe3++3OH-= Fe(OH)3↓
本题难度:一般
4、实验题 (16分)铜与浓硫酸反应,实验装置如图所示。
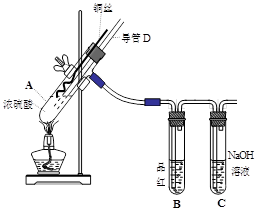
(1) 装置A中发生反应的化学方程式为:?????????????????????,反应过程中试管B中的现象是???????????????????????????,试管C的作用是?????????????????。
(2) 导管D的下端(虚线段)应位于??????????????(液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;②???????????????????????????????????????????????????????????。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
锻烧
?
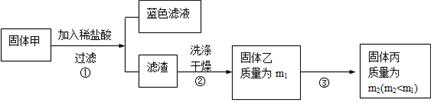 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:???????????????????????????????????????。 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:???????????????????????????????????????。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为????????????????????????????????????。
(5)结论:甲中有CuO,还肯定含有的物质是??????????。
参考答案:33.(16分)(1)Cu +2H2SO4(浓) △<
本题解析:
试题分析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端
本题难度:一般
5、填空题 (10分)向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)―→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段:??????????????????????????????????????????????????????????????????。
第二阶段:??????????????????????????????????????????????????????????????????。
(2)正确表达这两个阶段反应中,加入铁粉的物质的量与溶液中铁元素存在的形式的关系
???????????????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????????????。
(3)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
参考答案:(1)Fe+4H++NO=Fe3++NO↑+2H2O????
本题解析:
试题分析:(1)第一阶段的离子方程式为:Fe+4H++NO=Fe3++NO↑+2H2O。第二阶段加入的Fe会将生成的Fe3+还原成Fe2+,离子方程式为2Fe3++Fe=3Fe2+。
(2)第一阶段中0.8mol硝酸消耗铁粉0.2mol,产生Fe3+0.2mol,第二阶段消耗铁粉0.1mol,产生Fe2+0.3mol,所以当铁粉加入量大于0.2mol小于0.3mol时,既有Fe3+,又有Fe2+。
(3)此过程的图像为 本题难度:一般 本题难度:一般
|