微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体。
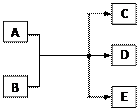
(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是??????????????;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是???????????;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是????????????????????????????????,G遇硝酸蒸气的现象是?????????????。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是?????????;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是????????????。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是??????????????????????????。
参考答案:(14分,每空2分)(1) Cl2+2NaOH=NaCl+N
本题解析:略
本题难度:一般
2、填空题 在下列物质转化关系中,反应的条件和部分产物已略去。

回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法?????? B.热还原法?????? C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是???????????????????????????????
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_?(填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是?????????????????????????????
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是?????????????????????????????
参考答案:17.(2)①C; ②3Fe+4H2O(g)=Fe3O4+4
本题解析:
试题分析:工业制备盐酸的反应,丙为H2,丁为HCl,(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,工业上制备钠采用电解法,故选C。②反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,处于周期表中第四周期第Ⅷ族,生成的磁性物质为Fe3O4,反应方程式为:3Fe+4H2O(g)=Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g)=Fe3O4+4H2(g);③
本题难度:困难
3、简答题 已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,甲、乙、丙均是由上述四种离子中的两种组成的化合物.甲、乙、丙溶于水所得溶液分别呈酸性、碱性和中性.
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解丙的溶液的方法制备该单质,制备反应的化学方程式是______;
(2)甲的化学式是______,乙的化学式可能是______;若将甲的溶液与乙的溶液混合产生沉淀和气体,则反应的离子方程式是______;
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,则正极反应式为______.
参考答案:X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离
本题解析:
本题难度:一般
4、填空题 (9分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
(1)写出由Y与Z形成的化合物Z2Y2的电子式:????????????,WY2与X2Y2反应生成粘稠油状液体的化学方程式:????????????????????????????????????????。
(2)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为:???????????????????????????????????????????????????。
(3)X、Y两种元素的单质已经被应用于飞船的燃料电池中,如图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
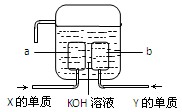
①a是装置的?????极。
②b极上的电极反应式是???????????????????。
参考答案:(9分)
⑴ 本题解析:X、Z、W分别与Y都能形成两种常见的化合物是本题推断元素的主要突破点:这两种常见的化合物分别为H2O、H2O2、Na2O、Na2O2。所以四种元素分别为:H、O、Na、S。
本题解析:X、Z、W分别与Y都能形成两种常见的化合物是本题推断元素的主要突破点:这两种常见的化合物分别为H2O、H2O2、Na2O、Na2O2。所以四种元素分别为:H、O、Na、S。
(3)组成了氢氧碱性燃烧电池,其中通入氢气的一方为负极,失电子:H2 +2e—+2OH— = 2H2O!通往氧气的一方为正极,得电子:O2 + 2H2O + 4e— = 4OH—;
本题难度:一般
5、简答题 A、B、C、D均为中学化学常见的纯净物,它们之间有如下的反应关系(反应物中的水没标出):A+B→C+D
(1)若上述反应是工业制玻璃的主要反应之一,B为氧化物,则B的化学式为______,B常被用来制造______,可用于通讯、能量传输、信息处理等.
(2)若A为短周期的金属单质,D为气态单质,B溶液呈强酸性或强碱性时,该反应都能进行,请写出反应的离子方程式______;______.
(3)常温下,若A为黄绿色气体,A、B均能使品红溶液褪色,相对分子质量C>D,则A与B在水溶液中反应化学方程式为______,检验D中阴离子的试剂是______.
参考答案:(1)上述反应是工业制玻璃的主要反应即二氧化硅和碳酸盐的反应
本题解析:
本题难度:一般