微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
选项
| 物质
| 除杂试剂
| 分离方法
|
A
| 乙酸乙酯(乙酸)
| NaOH溶液
| 分液
|
B
| 甲烷(乙烯)
| 酸性KMnO4溶液
| 洗气
|
C
| 苯(苯酚)
| 浓溴水
| 过滤
|
D
| 乙醇(乙酸)
| NaOH溶液
| 蒸馏
?
参考答案:D
本题解析:
试题分析:A.两种物质均与氢氧化钠反应,不能分离二者。A错误;
B.乙烯被高锰酸钾氧化产生二氧化碳气体,会引入新杂质。B错误;
C.苯酚与溴水反应生成的三溴苯酚会溶于苯而不能分离,C错误。
故选D。
点评:了解物质的特殊性质,注意除杂质又不能引入新杂质。
本题难度:一般
2、选择题 下列实验能达到预期目的的是
A.用溴水鉴别苯和溴苯
B.用BaCl2溶液鉴别SO42-和CO32-
C.用浓HNO3和Cu反应制取NO
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
参考答案:A
本题解析:
试题分析: A、溴水带橙色,苯的密度比水小,溴苯密度比水大所以当滴加溴水时,橙色在上层的是溴苯,橙色在下层的是苯;B、Ba2+与SO42-和CO32-都有沉淀生成;C、浓HNO3和Cu不反应;D、HCl易溶于水并与NaHCO3溶液反应生成CO2引入新杂质。
本题难度:一般
3、选择题 下列实验可行的是
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质反应的颜色变化鉴别部分蛋白质
D.用乙醇从碘水中萃取碘
参考答案:A
本题解析:
试题分析:A、铜与硝酸银溶液反应生成硝酸铜和单质银,因此可以除去硝酸铜溶液中的硝酸银,A正确;B、氢氧化钠溶液也能吸收CO2,B不正确,应该用饱和碳酸氢钠溶液除去CO2中混有的HCl气体;C、与蛋白质发生颜色反应的是浓硝酸,因此用浓硝酸与蛋白质反应的颜色变化鉴别部分蛋白质,C不正确;D、乙醇与水互溶,不能用乙醇从碘水中萃取碘,应该用四氯化碳或苯,D不正确,答案选A。
本题难度:一般
4、选择题 下列实验操作中,正确的是( ? ) A.在蒸发食盐水时,边加热边用玻璃棒搅拌直至液体蒸干
B.焰色反应实验前,铂丝应先用盐酸洗净,在酒精灯外焰灼烧至没有颜色
C.实验室制备氢氧化铁胶体时,向饱和三氯化铁溶液中滴加氢氧化钠溶液
D.配制一定物质的量浓度的NaOH溶液,将NaOH固体放在容量瓶中加水溶解
参考答案:B
本题解析:
本题难度:简单
5、实验题 (15分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
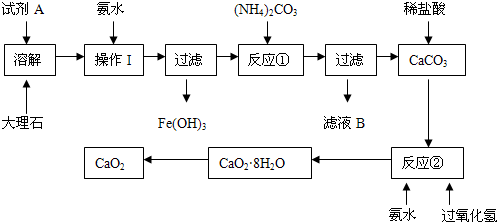
请回答下列问题:
(1)试剂A的名称是??????????????????;
(2)操作I的目的是?????????????????????????????????????;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有??????????????????????????????;
(4)写出反应②中生成CaO2·8H2O的化学方程式:??????????????????????????????????????????;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol?L-1的盐酸20.00mL,再用浓度为2.00mol?L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为????????。
参考答案:(1)硝酸或盐酸;?(2)调节溶液的pH,使Fe3+完全沉淀
本题解析:
试题分析:CaCO3能与稀HCl或稀硝酸发生反应,转化为可溶性物质,而硫酸与CaCO3反应产生的硫酸钙微溶于水,使反应不能继续进行。而Fe2O3能与酸反应得到可溶性的铁盐,因此试剂A是硝酸或盐酸;(2)向其中加入氨水的目的是调节溶液的pH,使Fe3+完全沉淀;然后过滤除去。(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有促进固体溶解的搅拌和为了分离难溶性固体与可溶性溶液的分离混合物的引流作用;(4)反应②中由CaCO3与H2O2?和氨水反应生成CaO2·8H2O的化学方程式是:CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)n(HCl)= 2.00mol/L×0.02L=0.04mol。n(NaOH)=n(HCl)(过量)= 2.00mol/L×0.011L-0.022mol。因此样品产生的OH-的物质的量为0.018mol.。设样品中含有CaO2、CaO的物质的量分别x、y。则2x+2y=0.018mol;72x+56y=0.6g。解得x=0.006mol;y=0.003mol。所以该样品中CaO2的质量分数为[(0.006mol×72g/mol)÷0.6]×100%=72%。
本题难度:一般
|