微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 胃酸过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作 用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是???????????????????(填化学式);乙中含有的主要化学成份是???????????????????????(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:?????????????????????。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
??????????????????????????????????;??????????????????????????????????????????。
参考答案:(每空2分,共10分)(1)NaHCO3; Al(OH)3
本题解析:
试题分析:(1)遇酸及酸性药物则产生二氧化碳,说明含有碳酸根离子或碳酸氢根离子,水溶液呈弱碱性,说明是强碱弱酸盐,灼烧时火焰为黄色,说明含有钠离子,白色结晶状粉末,受热可缓缓分解,碳酸钠不会分解,所以只能是碳酸氢钠;可溶于稀酸或氢氧化钠溶液中,该物质是一种两性碱,凝胶本身覆盖于溃疡面上,具有保护作用,说明该物质遇水会生成胶状物质,所以该物质是氢氧化铝,故答案为:NaHCO3;Al(OH)3;
(2)碳酸氢钠和盐酸的反应实质就是碳酸氢根离子和氢离子会生成水的反应,故答案为:HCO3-+H+═H
本题难度:简单
2、填空题 (本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
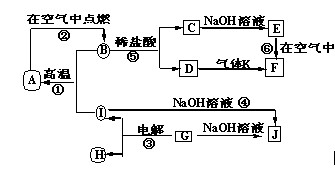
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置?????????,
(2)写出检验D溶液中阳离子的方法??????????????????????????????。
(3)写出反应④的离子方程式?????????????????????????????????????????。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:?????????????????????????????????????????????;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH??????7
(填“>”、“<”或“=”),用离子方程式表示其原因:??????????;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是?????????????????????????????????????????。
参考答案:
小题1:第四周期、第Ⅷ族
小题2:取少许D溶液
本题解析:略
本题难度:简单
3、填空题 某固体混合物可能由SiO2、Fe2O3、A12O3、Na2SO3、Na2CO3中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:
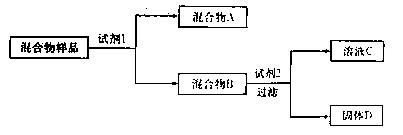
请回答下列问题:
(1)若试剂1是稀硫酸,试剂2是氢氧化钠溶液。在混合物样品中加以足量的稀硫酸后,固体全部溶解,得到混合气体A和澄清溶液B,在B中滴加过量氢氧化钠溶液时,先有沉淀生成,后沉淀部分溶解。则该混合物样品中一定不含的物质是????????????;固体D的化学式为??????;检验混合物B中含有Fe3+所选用的试剂是????????;证明混合气体A中含有CO2的实验方法是??????????????????。
(2)若试剂1是水,试剂2是氢氧化钠溶液(过量)。在混合物样品中加足量的水后过滤,混合物B是滤渣,试推断:固体D的化学式为??????????;检验溶液C中是否含有SiO32—的实验方法是??????????????。
参考答案:1)SiO2(2分)?? Fe(OH)3(2分)??硫氰化钾
本题解析:略
本题难度:一般
4、填空题 食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
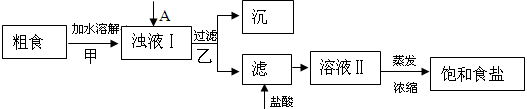
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液? NaOH溶液?? BaCl2溶液? Ba(NO3)2溶液
(1)①欲除去浊液Ⅰ中的Ca2+、Mg2+、SO42-,选出A所代表的试剂,按滴加顺序依次为?????????????(只填化学式),检验溶液中SO42-沉淀完全的操作为?????????????????????????。
②加盐酸的目的是(用离子方程式表示)?????????????????????????????????。
③上述流程中,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是甲??????,乙?????。
(2)工业上用惰性电极电解饱和食盐水法制取盐酸,写出电解饱和食盐水的化学方程式???????????;用试纸检验电解食盐水阳极产物的方法是??????????????????????。
参考答案:(1)①BaCl2、NaOH 、Na2CO3或NaOH、Ba
本题解析:
试题分析:(1)沉淀Ca2+用Na2CO3溶液、沉淀Mg2+用NaOH溶液、沉淀SO42-用BaCl2溶液,但要注意除杂试剂必须过量且过量的试剂后续过程中需除去,所以试剂滴加的顺序是BaCl2、NaOH 、Na2CO3或NaOH、 BaCl2、Na2CO3。检验SO42-沉淀完全的操作方法为将浊液静置,向上层清液中继续滴加氯化钡溶液,无沉淀生成,说明SO42-完全沉淀;滤液中加盐酸的作用是除去过量的CO32-和OH-;溶解时用玻璃棒搅拌,加快溶解速度。过滤时用玻璃棒引流。
(2)电解饱和食盐
本题难度:一般
5、填空题 (11分)短周
 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
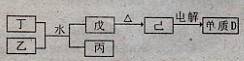
①丁与乙和水反应生成戊和丙的离子方程式为?????????????,由物质已电解得到单质D的化学方程式为?????????????????????????????;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为??????????????。
(2)已知E及其化合物有以下变化:
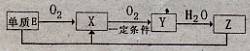
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式???????????。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____?(任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留, 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是??????。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是??????。
参考答案:
 本题解析:略
本题解析:略
本题难度:困难