微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某固体仅由一种元素组成,其密度为5.0g/cm3。用X-射线研究该固体的结构得知:在边长
10-7cm的正方体中含有120个原子,则此元素的相对原子质量最接近于下列数据中的 [???? ]
A.32
B.120
C.150
D.180
参考答案:C
本题解析:
本题难度:一般
2、选择题 在常温常压下呈气态的化合物,降温使其固化得到的晶体属于(??)
A.分子晶体
B.原子晶体
C.离子晶体
D.何种晶体无法判断
参考答案:C
本题解析:本题考查的是晶体类型的概念及不同类型晶体性质上的不同点。常温常压下呈气态的化合物,只可能是分子晶体;原子晶体和离子晶体常温常压下为固态。分子晶体三态变化时克服的是分子间作用力,化学键未遭到破坏,因此晶体类型不变。
本题难度:简单
3、填空题 Ⅰ.已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au。其堆积方式为:
(1)简单立方堆积的是____________________________________________;
(2)钾型的是______________________________________________________;
(3)镁型的是______________________________________________________;
(4)铜型的是_____________________________________________________。
Ⅱ.A、B、C、D都是短周期元素,原子半径D>C>A>B,已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。
试回答:
(1)这四种元素分别是:A______,B______,C______,D______(填元素名称)。
(2)这四种元素单质的熔点由高到低的顺序是________(填元素名称)。
(3)C的固态氧化物是________晶体,D的固态单质是________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式_______________________________________________________________。
参考答案:Ⅰ.(1)Po
(2)Na、K、Fe
(3)Mg
本题解析:Ⅱ.(1)当D原子最外层有1个电子时,则C原子最外层有4个电子(ⅣA
族),因为A与C为同一主族,且原子半径C>A,则短周期中C为Si,A为
C;当D原子最外层有2个电子时,则C原子最外层有8个电子(0族),据题
意知不可能。根据D的原子半径(最大)、最外层电子数(1个)、短周期可判断
D为Na。由质子数关系可判断B为O。
本题难度:一般
4、填空题 (15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是?????????????(填元素符合),写出基态Fe原子的核外电子排布式??????????。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有????????????,在右图的方框内用“→”标出Fe2+的配位键。
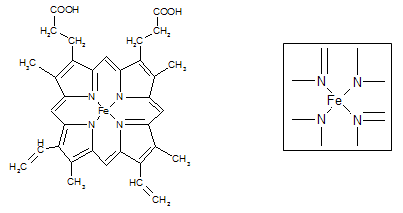
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
 ???
???
若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式???????, 1 mol O22+中含有的π键数目为?????。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为???,δ、α两种晶胞中铁原子的配位数之比为???。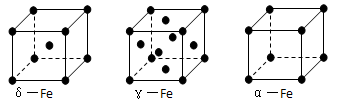
参考答案:⑴H (1分)?? [Ar]3d64S2(2分)
⑵s
本题解析:(1)非金属性越强,电负性越大,故是H。根据构造原理可写出基态Fe原子的核外电子排布式。
(2)根据结构图可看出N原子既有单键还有双键,所以既有sp2杂化,还有sp3杂化。N原子最外层有孤对电子,而亚铁离子有容纳电子的空轨道,所以可形成配位键。
(3)离子晶体中离子键越强,熔沸点越高,形成离子键的微粒半径越小,所带电荷数越多,离子键越强,所以NiO> FeO的。
(4)反应中有4mol N—H键断裂,则生成1.5mol氮气,氮氮三键由2个 本题难度:简单
本题难度:简单
5、选择题 某离子晶体的结构(局部如图所示)中,X位于立方体的顶点,Y位于立方体的中心。请回答:

(1)该晶体的化学式为
A.X4Y??????????? B.X2Y?????????????C.XY2???????????????????????D.XY
(2)晶体中,每个X的周围与它最接近且距离相等的X的数目为
A.4个??????????? B.6个????????????? C.8个??????????????? D.12个
参考答案:(1)B?(2)D
本题解析:(1)纯属于一个立方体的X为:4×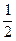 =2个,Y为1个,所以该晶体的化学式为X2Y。
=2个,Y为1个,所以该晶体的化学式为X2Y。
(2)各立方体在三维空间延伸的结果为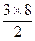 本题难度:简单
本题难度:简单