微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
参考答案:AD
本题解析:氨水是弱碱,若恰好反应,则生成的氯化铵水解,溶液显酸性。如果显中性,说明氨水是过量的,A、D正确,B不正确。根据电荷守恒c (H+) +c (NH4+) =?c (Cl-)+c (OH-)可知,如果混合溶液的pH=7,则溶液中c (NH4+)=c (Cl-),C不正确。答案选AD。
本题难度:一般
2、选择题 某溶液中在25℃时由水电离出的氢离子浓度为1×10-12 mol/L,下列说法正确 的是(???????)
的是(???????)
A.HCO3-离子在该溶液中一定不能大量共存
B.该溶液的pH一定是12
C.向该溶液中加入铝片后,一定能生成氢气
D.若该溶液的溶质只有一种,它一定是酸或碱
参考答案:A
本题解析:略
本题难度:一般
3、选择题 室温下,将1.000mol
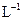 盐酸滴入20.00mL 1.000mol
盐酸滴入20.00mL 1.000mol
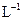 氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是?
氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是?
A.a点由水电离出的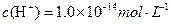
B.b点: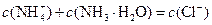
C.c点: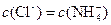
D.d点后,容易温度略下降的主要原因是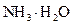 电离吸热
电离吸热
参考答案:C
本题解析:略
本题难度:一般
4、选择题 在200 mL某硫酸盐溶液中含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为(???? )
A.1 mol·L-1
B.2.5 mol·L-1
C.5 mol·L-1
D.2 mol·L-1
参考答案:B
本题解析:
正确答案:B
有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的化学式为M2 (SO4)3 , 该硫酸盐的物质的量浓度为1.5mol÷3÷0.200L="2.5" mol·L-1,故B正确。
本题难度:一般
5、选择题 下列物质溶解于水中,能促进水的电离的是(???? )
A.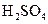
B.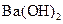
C.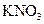
D.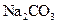
参考答案:
D
本题解析:
水的电离平衡是化学平衡的一种,影响 移动的因素,主要取决于温度和C(H+)、C(OH-)的大小。A项,C(H+)增大,平衡右移,抑制水的电离。B项 C(OH-)增大,平衡右移,抑制水的电离。C项,不影响水的电离,平衡不移动。D项,CO32—水解消耗水电离的H+,平衡左移,促进水的电离,D正确。
移动的因素,主要取决于温度和C(H+)、C(OH-)的大小。A项,C(H+)增大,平衡右移,抑制水的电离。B项 C(OH-)增大,平衡右移,抑制水的电离。C项,不影响水的电离,平衡不移动。D项,CO32—水解消耗水电离的H+,平衡左移,促进水的电离,D正确。
本题难度:简单