微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是(??? )
A.pH=7的溶液可能呈碱性
B.pH=6的溶液中c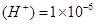
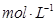
C.pH=6的溶液中c
D.室温下,任何物质的水溶液中都有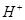 和
和 且K
且K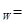 c
c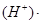 c
c
参考答案:C
本题解析:
试题分析:A.温度不同,水的离子积常数不同,则划分溶液酸碱性的pH值不同,如100 0C时,水的离子积为1?10-12,纯水的pH=6呈中性,pH=7的溶液呈碱性。所以A正确。
B. pH ="-lg" c(H+),pH=6,即c(H+)=1?10-6mol/L。正确。
C. pH=6的溶液中:c(OH-)=KW? c(H+),由于温度不确定,则KW值不确定,c(OH-)无法计算。C错误。
D.是水的离子积的概念,正确。
点评:理解水的离子积常数的意义和注意事项(在同一温度
本题难度:一般
2、填空题 (14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA
| NaOH
| 混合溶液的pH
|
甲
| C(HA)=0.2 mol·L-1
| C(NaOH)=0.2mol·L-1
| pH=a
|
乙
| C(HA)=c1 mol·L-1
| C(NaOH)=0.2mol·L-1
| pH=7
|
丙
| C(HA)="0.1" mol·L-1
| C(NaOH)=0.1mol·L-1
| pH=9
|
丁
| pH=2
| pH=12
| pH=b
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸???????????????????????????????????????????????????。
(2)若考虑其他组的实验结果,则c1 ??????(填“<”、“>”或“=”)0.2 mol·L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是???。
A.前者大??????????? B.后者大??????? C.二者相等???? D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是??????????????;其中,C(A-)=?????????mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前C(HA)????? (填“<”、“>”或“=”)C(NaOH);??? b?????? 7(填“<”、“>”或“=”)
参考答案:(1) a=7则HA为强酸;a﹥7则HA为弱酸???? (2
本题解析:a=7则HA为强酸;a﹥7则HA为弱酸。HA为弱酸,c1大于0.2 mol·L-1。HA溶液中C(A-)与NaOH溶液中C(Na+),后者大些。? CNa+﹥CA-﹥COH-﹥CH+, 0.05+10-9-10-5 mol·L-1丁组实验中,HA和NaOH溶液混合前C(HA)>C(NaOH)
本题难度:一般
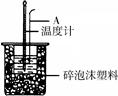
3、实验题 (16分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1)烧杯间填满泡沫塑料的作用是???????????????????????????????;
(2)大烧杯上若不盖硬纸板,求得的中和热数值?????????(填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H?????-57.3KJ/mol(填“>”、“<”或“=”);
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量?????????????(填“相等、“不相等”),
所求中和热??????????????(填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会??????????;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式??????????????????????????????????;
参考答案:(1)保温防止热量损失。?(2)偏小??(3)环形玻璃棒;△
本题解析:(1)在实验中应该尽可能的减少热量的损失,所以烧杯间填满泡沫塑料的作用是保温防止热量损失。
(2)大烧杯上若不盖硬纸板,则会造成热量的损失,测定结果偏低。
(3)根据仪器的结构可知,应该是是环形玻璃棒。由于酸能和氢氧化钠反应放出热量,所以造成氢氧化钠溶液的起始温度高,因此导致最终放出的热量偏少,则△H>-57.3KJ/mol。
(4)改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关。
(5)
本题难度:一般
4、选择题 分析以下几个热化学方程式,能表示燃烧热的是( )
A.C(s)+O2(g) ==CO(g)ΔH =" -110.5" kJ/mol
B.C(s)+O2(g) ==CO2(g)ΔH =" -393.5" kJ/mol
C.2H2(g)+O2(g)==2H2O(l)ΔH =" -571.6" kJ/mol
D.H2(g)+1/2O2(g)==H2O(g)ΔH =" -241.8" kJ/mol
参考答案:B
本题解析:
试题分析:1mol可燃物完全燃烧生成稳定的物质所放出的热量为燃烧热.A.碳完全燃烧后稳定产物为二氧化碳,不是一氧化碳,A错误,B正确;.C.可燃物不是1mol,C错误;D.产物为气态水,在常温下不能温度存在,应该生成液态水时放出的热量,D错误,答案选B.
考点:热化学方程式的书写
本题难度:一般
5、选择题 常温下,用 0.1000 mol·L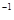 NaOH溶液滴定 20.00mL0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L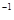 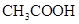 溶液所得滴定曲线如下图。下列说法正确的是 溶液所得滴定曲线如下图。下列说法正确的是

A.点①所示溶液中: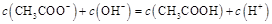
B.点②所示溶液中: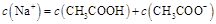
C.点③所示溶液中: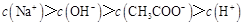
D.滴定过程中可能出现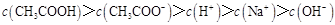
参考答案:D
本题解析:点①所示溶液中,醋酸是过量的,溶液显酸性。溶液是由等量的醋酸和醋酸钠混合而成的。由于醋酸的电离程度大于醋酸钠的水解程度,所以 。根据电荷守恒可判断 。根据电荷守恒可判断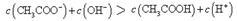 本题难度:一般 本题难度:一般
|