微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某课外兴趣小组对H2O2的分解速率做了科学探究采集的数据如下表:
(1)表一:用10mlH2O2制取150mlO2所需时间(秒)
时间(秒)
反应条件
浓度 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2
无催化剂不加热
几乎不反应
几乎不反应
几乎不反应
几乎不反应
无催化剂加热
360
480
540
720
MnO2催化剂加热
10
25
60
120
请问:①该研究小组在设计方案时.考虑了浓度、______、______等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中选一个说明该因素对分解速率有何影响?
______
(2)将质量相同但聚焦状态不同的MnO2分别加入到5ml5%的H2O2中,并用带火星木条测试,测定结果见表二:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需及时间
粉末状 | 混合不振荡
剧烈反应、带火星木条复燃
3.5分钟
块状
反应较慢,火星红亮但木条未复燃
30分钟
③写出H2O2分解的化学方程式______
④实验结果说明催化剂作用的大小与______有关.
参考答案:(1)①从表中数据看,浓度相同时,无催化剂不加热,几乎不反应
本题解析:
本题难度:一般
2、选择题 为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是
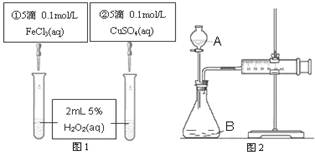
A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
D.图1实验可通过观察产生气泡的快慢来比较反应速率
参考答案:C
本题解析:A.图2中的A为分液漏斗,正确;B.反应速率可用单位时间内产生的气体体积表示,该装置可通过注射器活塞的位置变化看生成气体的体积,所以正确.C.催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以错误.D.图1实验可通过观察产生气泡的快慢来比较反应速率,正确。
本题难度:一般
3、选择题 下列措施对增大反应速率效果显著的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Cu与浓硝酸的反应中,将Cu片改成Cu粉
参考答案:A.因水为纯液体,改变用量对反应速率无影响,则Na与水反应时
本题解析:
本题难度:简单
4、选择题 在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 参考答案:B 参考答案:B
本题解析:
试题分析:A.由于反应2SO2(g)+O2(g) 2SO3(g)的正反应是放热反应,所以若升高温度,平衡向吸热反应方向即向逆反应方向移动,所以达到平衡时SO3的含量降低,乙的温度较高,错误;B.若使用催化剂,正反应速率和逆反应速率都增大,而且增大的倍数相等,所以平衡不发生移动,所以图Ⅱ表示t0时刻使用催化剂对反应速率的影响,正确;C.若通入氦气,由于物质的浓度不变,所以化学反应速率不变,错误;D. t0时刻增大O2的浓度,在那一瞬间,反应物的浓度增大,正反应速率增大,而逆反应速率不变,所以平衡正向移动,与图像不符合,错误。 2SO3(g)的正反应是放热反应,所以若升高温度,平衡向吸热反应方向即向逆反应方向移动,所以达到平衡时SO3的含量降低,乙的温度较高,错误;B.若使用催化剂,正反应速率和逆反应速率都增大,而且增大的倍数相等,所以平衡不发生移动,所以图Ⅱ表示t0时刻使用催化剂对反应速率的影响,正确;C.若通入氦气,由于物质的浓度不变,所以化学反应速率不变,错误;D. t0时刻增大O2的浓度,在那一瞬间,反应物的浓度增大,正反应速率增大,而逆反应速率不变,所以平衡正向移动,与图像不符合,错误。
考点:考查图像法在化学反应速率和化学平衡的移动中的作用的知识。
本题难度:一般
5、填空题 (14分)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g)下表为不同温度下的平衡常数(K) CH3OH(g)下表为不同温度下的平衡常数(K)
|
|
网站客服QQ: 960335752 - 14613519 - 791315772