微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-Q1;2H2(g)+O2(g)=2H2O(g);ΔH=-Q2;2H2(g)+O2(g)=2H2O(l);ΔH=-Q3。常温下,取体积比为4∶1的甲烷和 氢气的混合气体?11.2?L(标准状况),经完全燃烧后恢复到常温,则放出的热量 为(??)
A.0.4Q1+0.05Q3
B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3
D.0.4Q1+0.2Q2
参考答案:A
本题解析:n(气体)=11.2L/22.4L·mol-1=0.5mol,其中,n(CH4)=0.5mol×4/5=0.4mol,n(H2)=0.5mol×1/5=0.1mol。据有关热化学方程式得知0.4molCH4与0.1molH2分别完全燃烧恢复到常温放热0.4Q1和0.1×1/2Q3=0.05Q3,放出总热量为0.4Q1+0.05Q3。
本题难度:一般
2、选择题 已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法错误的是?
[???? ]
A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B.H2(g)+F2(g)=2HF(g) △H=-270 kJ/mol ,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
C.相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+ O2是一个吸热反应
D.破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3
参考答案:AB
本题解析:
本题难度:一般
3、选择题 下列变化中,一定需要加入还原剂才可以实现的是
A.Ag→Ag+
B.CO2→H2CO3
C.Cl2→NaCl
D.FeCl3→FeCl2
参考答案:D
本题解析:分析:在氧化还原反应中,一定需要加入还原剂才可以实现,说明所给物质为氧化剂,在反应中得电子化合价降低,据此分析解答.
解答:A.该反应中,银元素失电子化合价升高,则需要加入氧化剂才能实现,故A错误;
B.该反应中,元素的化合价没有变化,不用发生氧化还原反应,与水反应即可实现,故B错误;
C.氯气和氢氧化钠反应生成氯化钠,氯气和氢氧化钠的反应中氯气既是氧化剂又是还原剂,所以要实现Cl2→NaCl不一定需要加入还原剂,故C错误;
D.FeCl3→FeCl2中Fe元素的化合价降低,发生还原反应,则需要加入还原剂才能实现转化,如加入Fe,故D正确;
故选D.
点评:本题考查氧化还原反应,明确元素的化合价降低发生还原反应,需要加入还原剂时解答本题的关键,并应熟悉物质或离子中元素的化合价来解答.
本题难度:一般
4、选择题 下列变化为放热的化学反应的是( )
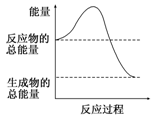
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如图所示的化学反应
参考答案:D
本题解析:选项A不是化学变化,不正确;选项B是吸热反应;形成化学键一定是放热的,但相应的化学反应不一定是放热反应,选项C不正确;根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,答案选D。
本题难度:一般
5、选择题 据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是(?????)
A.甲认为上述报道是假新闻,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
参考答案:D
本题解析:
试题分析:A.因理论具有一定的时代性和局限性,宇宙中发现H3分子,则存在该分子,故A错误;
B.同位素的种类与同素异形体的种类无关,则可能还有氢单质,也可能没有,故B错误;
C.分子与离子是不同的微粒,所以H3分子不能写出H3+,故C错误;
D.H3分子的存在,利用传统的价键理论不能解释,即传统的价键理论有一定的局限性有待继续发展,故D正确;
故选D。
点评:本题考查化学键,题目难度较大,注意理论的时代性和局限性是解答本题的关键,注意宇宙中发现H3分子,即存在该物质来
本题难度:一般