微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫和浓氢氧化钠溶液共热至沸,反应后,硫转化为S2-、SO32-,则反应的S和生成的S2-、SO32-的物质的量比为???????????????????????????????????????????????????????????
A.2∶1∶1
B.3∶2∶1
C.3∶1∶2
D.4∶1∶3
参考答案:B
本题解析:因为S由反应前的零价变为反应后的-2价(S2-)和+4价(SO32-),硫和强碱发生了氧化还原反应,由题意可写出下列反应方程式:
3S+6NaOH====2Na2S+Na2SO3+3H2O,所以参加反应的S,S2-,SO32-物质的量之比为3∶2∶1。
本题难度:一般
2、填空题 (本题共12分)
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7?? Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7?? Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
参考答案:(1)5H2S+2KMnO4+3H2SO4→K2SO4+2M
本题解析:
试题分析:(1)根据反应物和生成物,借助于质量守恒定律和电子得失守恒可知反应的化学方程式为5H2S+2KMnO4+3H2SO4→K2SO4+2MnSO4+8H2O+5S↓。
(2)H2S不完全燃烧可以生成单质硫,高温下H2S分解也生成单质硫。另外SO2也能与H2S反应生成单质硫,而H2S完全燃烧即产生 SO2,因此有关的反应的化学方程式为2H2S+3O2点燃2SO2+2H2O,2H2S+2SO2→3S+2H2O;H2S△S+H2或2H2S+O2点燃2
本题难度:一般
3、计算题 某样品含亚硫酸钠和少量的硫酸钠。现取一定量样品溶于100mL水配成溶液,再加足量的氯化钡溶液,过滤、洗涤、干燥,得沉淀13.18g。若将这些固体中加入足量的稀盐酸,充分反应后,再 过滤、洗涤、干燥,得固体不溶物为2.33g。则:(1)样品中亚硫酸钠的物质的量为多少? (2)样品中硫酸酸钠的质量分数为多少?
参考答案:(1)0.05 mol
(2)0.184
本题解析:(注:解题过程必须详细、完整、按步骤给分)。
Na2SO4+BaCl2=BaSO4↓+2NaCl
硫酸钡:2.33g/233g?mol-="0.01mol?" 硫酸钠:1.42g
Na2SO3+BaCl2=BaSO3↓+2NaCl
亚硫酸钡:13.18g — 2.33g =" 10.85" g
亚硫酸钠:6.3g??? n="0.05" mol
硫酸钠的质量分数:1.42g/(1.42+6.3)g= 0.184
本题难度:简单
4、选择题 在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( ? )
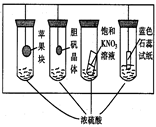
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出
D.蓝色石蕊试纸变红
参考答案:D
本题解析:
试题分析:浓硫酸具有脱水性、吸水性和强氧化性,因此选项ABC都是正确的,D中蓝色石蕊试纸应该是先变红后变黑,答案选D。
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,主要是检验学生对浓硫酸性质的酸性掌握程度,以及灵活运用浓硫酸的性质解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
5、选择题 下列关于浓硫酸和浓硝酸的叙述,属于二者共同具有的性质是
A.具有吸水性,可做干燥剂
B.可用作氧化剂
C.其钡盐难溶于水
D.能与浓盐酸按一定比例混合,所得的混合酸可溶解铂和金
参考答案:B
本题解析:略
本题难度:一般