微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铝制器皿能够盛放的物质是
A.KOH溶液
B.浓硫酸
C.NaOH溶液
D.稀硫酸
参考答案:B
本题解析:
试题分析:铝能和氢氧化钠、氢氧化钾溶液以及稀硫酸反应,不能用来盛放。在常温下,铝在浓硫酸中发生钝化,可以盛放,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是记住单质铝的化学性质,然后灵活运用即可。
本题难度:简单
2、选择题 下列关于硝酸和硫酸的叙述中,错误的是(?? )
A.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
参考答案:A
本题解析:浓硫酸有强氧化性、吸水性、脱水性,浓硝酸没有脱水性。A错误。常温情况下铝、铁在冷的浓硫酸和浓硝酸中发生钝化反应,B正确。稀硫酸有酸性也有氧化性,氢离子的氧化性,浓硝酸和稀硝酸都有氧化性,而且都是重要的化工原料。CD正确。
本题难度:简单
3、计算题 两份不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
参考答案:0.150mol/L、0.240mol/L。
本题解析:解答本题时,一要挖掘隐含的两个反应;二要运用平均值规律通过对“5.75g”和“7.10g”的量的分析,判断溶质的组成。
SO2与NaOH作用可能的反应有:
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500molNa2SO3或NaHSO3,质量是6.30g或5.20g。依题意,两份溶液中,含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3
本题难度:简单
4、计算题 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):

(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
_____________________________________________________________________
(2)在400~500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:___________;
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___________(填“是”或“否”),是否可以增大该反应所放出的热量?___________(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用___________吸收SO3;
(5)已知:2SO2(g)+O2(g)===2SO3(g)?ΔH=-196.6 kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
参考答案:(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利
本题解析:(1)从题中表格数据可以看出同一压强下不断升高温度,SO2的转化率不断降低,说明可逆反应2SO2(g)+O2(g)  2SO3(g)正向为放热反应。
2SO3(g)正向为放热反应。
(2)从表中数据可以看出400~500℃,10Mpa时,SO2的转化率为99.3%~99.9%,可是常压下SO2的转化率已经很高,压强增大100倍,转化率提高
本题难度:一般
5、简答题 火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有????????????????(填写字母编号)
A水体富营养化???? B重金属污染?????? C雾霾????? D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式?????????????????。
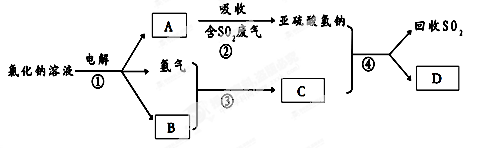
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式??????,若生成ag A,理论上可以回收SO2的质量为??????g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式???????????????。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式????????????。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式???????????。
参考答案:(1)CD?
(2)Ca(HSO3)2+O2=CaSO
本题解析:(1)氮氧化物和二氧化硫能引起酸雨,PM2.5直径小于等于2.5 微米的颗粒物,能长时间悬浮于空气中,能造成雾霾,故CD项正确。
(2)亚硫酸氢钙被足量氧气氧化生成硫酸钙,同时生成H2SO4,化学方程式为:Ca(HSO3)2+O2=CaSO4+H2SO4
(3)电解氯化钠溶液可得Cl2、H2、NaOH,A能吸收SO2,生成亚硫酸氢钠,则A为NaOH;SO2与NaOH反应的化学方程式为:SO2+NaOH=NaHSO3,NaOH的质量为ag,则理论上可以回收SO2的质量为:64/40×ag=1.6
本题难度:一般