H2
能量(kJ)
243
193
151
432
366
298
436
(1)在HCl、HBr、HI中,最稳定的是______;
(2)对于反应X2+H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是______;
(3)反应Br2+H2=2HBr,当生成2mol?HBr时放出______?kJ能量.
参考答案:(1)因化学键越强,破坏物质中的化学键所吸收的能量也大,化合
本题解析:
本题难度:一般
2、选择题 以下关于下图说法正确的是

A.如图表明催化剂可以改变反应的热效应
B.如图表示某反应能量的变化与生成物状态无关
C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
参考答案:D
本题解析:
试题分析:A.催化剂不能改变反应的热效应,只能改变反应的活化能,错误。B.反应能量的变化与生成物状态及量都有关系,错误。C.右图表示的是放热反应,错误。D.右图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒,正确。
本题难度:一般
3、填空题 (共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为????????????????????????????????????????????????。
②又已知H2O(l)=H2O(g)?? ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是??????????????kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是??????????????????????????????????????????????????????????????????。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)???????△H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)?????△H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)????????△H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________?????????????????????????????????????????????????????
参考答案:(1)①N2H4(l)+2H2O2(l) = N2(g) +
本题解析:
试题分析:(1)①根据题意知,肼和双氧水反应生成氮气和水,化学方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量,则1mol液态肼反应放出的热量为644.25kJ,热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=—644.25kJ/mol;②根据①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=—644.25kJ/mol;②H2O(l)=H2O(g)△H=
本题难度:一般
4、实验题 (7分)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是???????????????????????????????????????????????。
(2)写出有关反应的化学方程式????????????????????????????????????????????。
(3)实验中观察到的现象有???????????、?????????????????和反应混合物成糊状。
(4)通过????????现象,说明该反应为????????(填“吸热”或“放热”)反应,这是由于反应物的总能量????????????(填“小于”或“大于”)生成物的总能量。
参考答案:(1)搅拌使混合物充分接触并反应
(2)Ba(OH)2
本题解析:考查了化学反应与能量之间的关系,Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是常温下进行一个典型吸热反应。
本题难度:一般
5、选择题 相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  ?2XY3(g)???△H=-92.6 kJ·mol-1 ?2XY3(g)???△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
| 起始时各物质物质的量/mol
| 达平衡时体系能量的变化
| X2
| Y2
| XY3
| ①
| 1
| 3
| 0
| 放热 23.15 kJ
| ②
| 0.6
| 1.8
| 0.8
| Q(Q>0)
下列叙述不正确的是????
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
参考答案:B
本题解析:
试题分析:A.因为同一反应在相同的温度下的平衡常数不变,故容器①、②中反应的平衡常数相等,正确;B.容器②中反应可视为是容器①已经反应了一部分,故达到平衡时放出的热量Q<23.15kJ,原说法不正确;C.容器①、②中达平衡时的等效的,由①可知生成n(XY3)=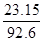 ×2mol=0.5mol,故c(XY3)=< ×2mol=0.5mol,故c(XY3)=<
本题难度:一般
|
|