微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为??????????????????????,该反应中氧化剂为________???????????.
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________??????
参考答案:(1)Cu2S? +? O2 =2Cu? +?? SO2??
本题解析:(1)根据物质的组成可知,生成物除铜以外,还与SO2生成,所以反应的方程式是Cu2S? +? O2 =2Cu? +?? SO2;根据方程式可知,氧元素和铜元素的化合价都是降低的,所以氧化剂是O2和Cu2O。
(2)由于在反应过程中,硫酸的浓度逐渐降低,而稀硫酸和铜是不反应的,所以被还原的硫酸小于0.9mol。
(3)溶液中还原氯化铜、氯化铁、氯化亚铁,所以首先加入足量的铁粉置换出铜,即X是铁。由于铁过量,所以在金属混合物中加入盐酸溶解铁,过滤、洗涤干燥即得到铜,因此Y是盐酸。要把氯化亚铁变成氯
本题难度:一般
2、选择题 据报道,纳米Fe3 O4晶体材料可以作为核磁共振造影增强剂 ,用于疾病的诊断和作为药物载体用于疾病的治疗。其制备过程如图所示、下列叙述不合理的是
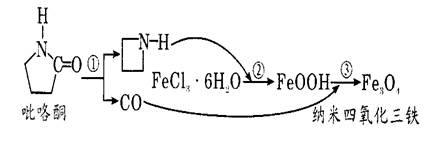
A.Fe3O4可以表示为 FeO·Fe2O3,属于混合物
B.反应③的化学方程式是:6FeOOH + CO ==2Fe3O4+3H2O+CO2