微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 足量的下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是(??)
A.氢氧化钠溶液
B.稀硫酸
C.盐酸
D.稀硝酸
参考答案:A
本题解析:本题考查金属铝的性质,意在考查考生运用元素化合物知识的能力。根据关系式:2Al~2NaOH,2Al~3H2SO4,2Al~6HCl,A项正确,B、C项错误;Al与稀硝酸反应不产生氢气,D项错误。
本题难度:简单
2、选择题 将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液的溶质质量分数为(???)
A.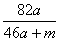 %
%
B.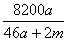 %
%
C.a/2%
D.3a/2%
参考答案:C
本题解析:由2Na+2H2O 2NaOH+H2↑,2Al+2NaOH+2H2O
2NaOH+H2↑,2Al+2NaOH+2H2O 2NaAlO2+3H2↑可知:
2NaAlO2+3H2↑可知:
2Na
本题难度:简单
3、选择题 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4的物质的量浓度之比为
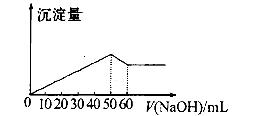
A.6:1
B.3:1
C.2:1
D.1:2
参考答案:D
本题解析:
试题分析:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=1/2×
本题难度:一般
4、填空题 向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
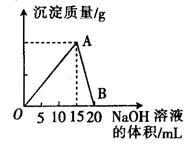
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。
参考答案:(1)AlCl3与NaOH恰好完全反应,生成最大沉淀量。(2
本题解析:
试题分析:向可来源:91考试网 91exam.org溶性铝盐的溶液中滴加NaOH至过量,先生成沉淀,后溶液又变澄清;结合图像,当沉淀量不是最大值时消耗的NaOH的量即为两种可能。NaOH不足或达到最大沉淀量后,部分沉淀被过量的NaOH溶解。
本题难度:一般
5、选择题 下列物质中,属于两性氧化物的是:
A.Al
B.Al(OH)3
C.Al2O3
D.SO2
参考答案:C
本题解析:
试题分析:首先,题意为两性氧化物,故A、B项错误;D项SO2为酸性氧化物。故选C项。
点评:本题需要学生熟练掌握铝及铝的化合物的两性,这属于重点知识,要理解记忆。
本题难度:一般