微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氢氧化铝与其他的氢氧化物不同,既能与酸反应生成盐和水,又能与碱反应生成盐和水,试用离子方程式表示它与酸和碱反应的原理。
参考答案:Al(OH)3+3H+ 本题解析:教材上既有氢氧化铝与盐酸和氢氧化钠反应的实验又有化学方程式,我们只需将化学方程式改写成离子方程式即可。
本题解析:教材上既有氢氧化铝与盐酸和氢氧化钠反应的实验又有化学方程式,我们只需将化学方程式改写成离子方程式即可。
本题难度:一般
2、填空题 (10分) 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
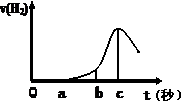
(1)关于图像的描述不正确的是??????????(填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为??????mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有 ??
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;②???????????????????????????????????;
参考答案:(1)①③;(2)V/11.2(c—b)?mol/(L·s)
本题解析:
试题分析:(1)① o→a段不产生产生H2是由于金属铝表面有一层氧化膜,氧化铝与稀硫酸反应生成硫酸铝和水,错误;② b → c段产生H2较快可能是反应放热,温度升高,加快了反应,正确;③ 根据题给数据知,铝过量,c以后,产生H2速率逐渐下降原因可能是稀硫酸趋于消耗完全,错误,选①③;(2)在b到c这段时间内,收集到氢气VL(标准状况),物质的量为V/22.4mol,时间为(c—b)s,硫酸的物质的量变化为V/22.4mol,则这段时间内用硫酸表示的平均速率为V/11.2(c—b)?mol/(L·s
本题难度:一般
3、选择题 物质的量为0.20 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.6.4g
B.8.0g
C.8.4g
D.9.2g
参考答案:D
本题解析:
试题分析:若气体只有CO2,有2Mg+CO==2MgO+C可知,0.20 molMg生成0.20 molMgO和0.10molC,共计9.2g,因含有O2而低于此计量,但多余Mg自身质量4.8g。故选D。
本题难度:一般
4、填空题 (14分)以明矾石[主要成分为K2SO4·Al2(SO4)3·2A12O3·6H2O]为原料生产硫酸铝晶体[Al2(SO4)3·18H2O]和明矾[KAl(SO4)2·12H2O]的实验流程如下:

两种不同形态的氧化铝的部分性质如下表:
物质
| α-Al2O3
| γ-A12O3
|
性质
| 不溶于水和酸
| 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3
Al2(SO4)3、明矾在不同温度下的溶解度如下表:
????温度/℃
溶解度/g
| 0
| 20
| 40
| 60
| 80
| 100
| Al2(SO4)3
| 31.2
| 36.4
| 46.1
| 59.2
| 73.0
| 89.0
| 明矾
| 3.0
| 5.9
| 11.7
| 25
| 71
| 154
(1) “焙烧’’温度过高,会导致硫酸铝晶体产量降低,其原因是???????????。
(2)从“母液”制备硫酸铝晶体的实验步骤为:①??????????;②??????????;③过滤、洗涤、干燥。
(3)测定硫酸铝晶体样品中Al2(SO4)3·18H2O质量分数的实验步骤为(EDTA分别能与Al3+或Pb2+以物质的量之比1:1进行反应):
步骤1:准确称取硫酸铝晶体样品mg,溶于25 mL水中。??
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,滴加指示剂,用c2 mol·L-1Pb(NO3)2标准溶液滴定过量的EDTA溶液,达到终点时消耗v2mL Pb(NO3)2标准溶液。
①步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、????。
②根据上述数据计算,该样品中Al2(SO4)3·18H2O的质量分数为??????????。(用含字母的代数式表示)。
(4)铝的阳极氧化法是把铝作为阳极,置于硫酸等电解液中,施加阳极电压进行电解,在铝的表面形成一层致密的氧化膜。
①电解过程中阳极的电极反应为??????????????。
②取少量废电解液,加入NaHCO,溶液后产生气泡和白色沉淀,产生沉淀的原因是???????????????。(用离子方程式表示)
参考答案:(1)γ-A12O3转化为难溶于硫酸的α-Al2O3(2分)
本题解析:
试题分析:(1)γ-A12O3转化为难溶于硫酸的α-Al2O3,导致硫酸铝晶体产量降低,(2)过滤之前的步骤为①蒸发浓缩②冷却结晶(3)①稀释时还需要的仪器是100 mL容量瓶和胶头滴管,②根据方程式进行计算Al2(SO4)3·18H2O的物质的量=C1V1+4C2V2,所以质量分数为物质的量乘以摩尔质量,再除以样品的总质量,最后质量分数求得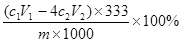 本题难度:困难 本题难度:困难
5、简答题 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a?g,溶于200mL?5mol/L?HCl溶液中,共收集到标准状况下的氢气3.36L.
(1)a?的取值范围是______.
(2)向反应后所得溶液中逐渐加入4mol/L的NaOH溶液,当沉淀质量达到最大值时,加入的NaOH溶液的体积是______mL,沉淀的最大质量是______g.(用含a?的代数式表示)
(3)继续加入NaOH溶液至沉淀不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a?g,计算原混合物中铝的质量分数(写出计算过程).
参考答案:(1)根据氢气体积,可以确定氢气物质的量为
本题解析:
本题难度:一般
|
|