微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)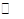 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将????????(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)=?????????mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为????????????????????????????????????????????????。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中?? 0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:

①P1???????P2 ?(填“<”、“>”或“=”)。
②在P1压强下,100℃时,反应CO(g)+2H2(g)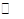 CH3OH(g)的平衡常数K的值为?????????
CH3OH(g)的平衡常数K的值为?????????
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率??????????(填“增大”、“不变”或“减小”),CH3OH的体积分数????????(填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率????(填“增大”、“不变”或“减小”),c(CH3OH)????0.1mol/L(填“>”、“<”或“ = ”)
参考答案:(1)减小(1分) 0.03mol·L-1·min-1(2
本题解析:(1)降低温度,反应速率一定是减小的。根据方程式可知,0.1molCO生成,则同时生成氢气0.3mol,所以氢气的反应速率是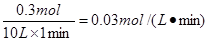 ??????????????????????????????。
??????????????????????????????。
(2)根据反应物和生成物并结合原子守恒可知,反应的方程式为
2CO+4H2 CH3OCH3+H2O。
CH3OCH3+H2O。
(3)①根据方程式可知,该反应是体积减小的。因此增大压强,平衡向正反应方向移动,CO的转化率增大,所以根据图像可判断,P1小于P2。
②根据图像可知,在P1压强下,100℃时,CO的转化率是0.5,所以平衡时生成甲醇0.1mol,浓度是0.05mol/L。剩余CO和氢气分别是0.1mol和0.2mol,浓度分别是0.05mol/L和0.1mol/L。因此平衡常数是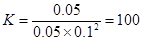 ;再加入CO,则平衡向正反应方向移动,但CO的转化率降低;如果此时氢气全部转化,则生成甲醇是0.2mol,剩余CO是1mol,则甲醇的含量是1/6<1/4,即甲醇的含量是降低的。
;再加入CO,则平衡向正反应方向移动,但CO的转化率降低;如果此时氢气全部转化,则生成甲醇是0.2mol,剩余CO是1mol,则甲醇的含量是1/6<1/4,即甲醇的含量是降低的。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,则相当于增大压强,平衡向正反应方向移动,CO的转化率增大,甲醇的浓度大于0.1mol/L。
本题难度:一般
2、选择题 已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
A.Q2<Q1<197 kJ·mol-1
B.Q2=Q1=197 kJ·mol-1
C.Q1<Q2<197 kJ·mol-1
D.Q2=Q1<197 kJ·mol-1
参考答案:A
本题解析:
试题分析:2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
本题难度:一般
3、选择题 用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
A.醋酸的电离程度逐渐增大,溶液的PH值减小
B.Kw逐渐减小
C.水的电离程度增大
D.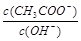 变大
变大
参考答案:C
本题解析:
试题分析:加水稀释醋酸,促进电离,n(H+)增大,c(H+)减小,pH增大,A错误;Kw与温度有关,加水稀释,Kw不变,B错误;加水稀释醋酸,醋酸浓度减小,水的电离程度增大,C正确; ,加水稀释,K(CH3COOH)、Kw不变,c(CH3COOH)减小,所以
,加水稀释,K(CH3COOH)、Kw不变,c(CH3COOH)减小,所以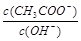 减小,D错误。
减小,D错误。
点评:酸碱抑制水的电离,能水解的盐促进水的电离
本题难度:简单
4、选择题 对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g)。下列反应速率关系中,正确的是 [???? ]
A.v(W)=3v(Z)
B.2v(X)=3v(Z)
C.2v(X)=v(Y)
D.3v(W)=2v(X
参考答案:C
本题解析:
本题难度:简单
5、选择题 从植物花汁中提取的一种有机物HIn,可做酸、碱指示剂,在水溶液中存在电离平衡:HIn(红色)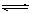 H+ + In-(黄色)△H>0对上述平衡解释不正确的是
H+ + In-(黄色)△H>0对上述平衡解释不正确的是
A.升高温度平衡向正方向移动
B.加入盐酸后平衡向逆方向移动,溶液显红色
C.加入NaOH溶液后平衡向正方向移动,溶液显黄色
D.加入NaHSO4溶液后平衡向正方向移动,溶液显黄色
参考答案:D
本题解析:
试题分析:正反应是吸热反应,所以升高温度平衡向正方向移动,A正确;加入盐酸后增大氢离子浓度,平衡向逆方向移动,溶液显红色,B正确;加入NaOH溶液后消耗氢离子,降低氢离子浓度,平衡向正方向移动,溶液显黄色,C正确;加入NaHSO4溶液后增大氢离子浓度,平衡向逆方向移动,溶液显红色,D不正确,答案选D。
点评:电离平衡也是动态平衡,适用于勒夏特列原理。
本题难度:一般