微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质,可以直接用分液漏斗分离的是:? (??? )
A.酒精和碘
B.硝基苯和水
C.乙醇和水
D.溴和溴苯
参考答案:B
本题解析:
试题分析:A、酒精与碘互溶,不能用分液漏斗分离,错误;B、硝基苯不溶于水,所以溶液分层,能用分液漏斗分离,正确;C、乙醇与水互溶,不能用分液漏斗分离,错误;D、溴与溴苯互溶,不能用分液漏斗分离,错误,答案选B。
本题难度:简单
2、选择题 用NA表示阿伏伽德罗常数.下列说法正确的是
A.标准状况下,11.2L乙烯含有的共用电子对数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.2L1mol/LNa2S溶液中S2-和HS-的总数为2NA
D.65g锌和一定量浓硫酸反应完全,生成的气体分子数为NA
参考答案:D
本题解析:分析:A、根据乙烯的结构判断,乙烯中含有4个C-H键和1个C=C键;
B、NO和O2的反应生成NO2,分子数减少,并且不在标况下,无法判断物质的量的多少;
C、根据物料守恒和Na2S的水解来判断;
D、根据锌与浓硫酸和稀硫酸反应转移的电子数来判断.
解答:A、乙烯中含有4个C-H键和1个C=C键,即1mol乙烯中含有的共用电子对的物质的量为6mol,则标准状况下,11.2L乙烯含有的共用电子对数为3NA,故A错误;
B、反应不在标况下,无法判断物质的量的多少,并且NO和O2的反应生成NO2,分子数减少,故B错误;
C、Na2S溶液中S2-水解生成HS-和H2S,根据物料守恒n(S2-)+n(HS-)+n(H2S)=2mol,则2L1mol/LNa2S溶液中S2-和HS-的总数小于2NA,故C错误;
D、根据电子转移的数目判断,1molZn与浓硫酸反应生成1molSO2气体,1molZn与浓硫酸反应生成1molH2气体,所以无论是浓硫酸还是稀硫酸,65g锌和一定量浓硫酸反应完全,生成的气体分子数为NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数的有关判断,题目难度不大,做题时注意物质的聚集状态、存在条件、物质的组成、结构和性质等知识.
本题难度:一般
3、选择题 关于1 mol·L-1的Na2SO4溶液的叙述正确的是
A.溶液中含2 molNa+
B.Na+的浓度为1 mol·L-1
C.配制时,将1 molNa2SO4溶于1 L水中
D.将322 gNa2SO4·10 gH2O溶于少量水后再稀释成1 L,即配制成相应浓度的溶液
参考答案:D
本题解析:
本题难度:一般
4、选择题 利用实验器材(规格和数量不限),能完成相应实验的一项是
?
| 实验器材(省略夹持装置)
| 相应实验
|
A
| 烧杯、玻璃棒、蒸发皿
| 硫酸铜溶液的浓缩结晶
|
B
| 烧杯、玻璃棒、胶头滴管、滤纸
| 用盐酸除去硫酸钡中的少量碳酸钡
|
C
| 烧杯、玻璃棒、胶头滴管、容量瓶
| 用固体氯化钠配制0.5mol/L的溶液
|
D
| 烧杯、玻璃棒、胶头滴管、分液漏斗
| 用溴水和CCl4除去NaBr溶液中的少量NaI
?
参考答案:D
本题解析:
试题分析:A项缺少酒精灯;B项缺少漏斗;C项缺少托盘天平.
本题难度:一般
5、实验题 (6分)有一瓶澄清的溶液,其中可能含有 、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、 、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、 、 、 、 、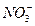 、Cl-、Al O2-、I-,取该溶液进行如下实验: 、Cl-、Al O2-、I-,取该溶液进行如下实验:
(1)用pH试纸实验,表明溶液呈强碱性,焰色反应透过蓝色钴玻璃观察到紫色火焰。
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经摇荡后,CCl4层呈紫红色。
(3)另取部分溶液,逐滴加入稀HCl溶液,使溶液从碱性逐渐变为酸性,在滴加过程中溶液出现沉淀。滴加完毕后,溶液中沉淀消失。
(4)取部分上述酸性溶液,加BaCl2溶液,有白色沉淀生成。
(5)往(3)得到的酸性溶液通H2S气体,溶液中有浅黄色沉淀产生。
根据上述实验事实确定并完成下列问题:
在溶液中肯定存在哪些离子_________________________________________,
肯定不存在哪些离子_______________________________________________,
还不能确定存在哪些离子___________________________________________。
参考答案:K+、I-、Al O2-、 本题解析:第(1)(2)比较容易确定溶液中含有K+、I-等离子,而没有 本题解析:第(1)(2)比较容易确定溶液中含有K+、I-等离子,而没有 、Mg2+、Al3+、Fe2+等离子。第(3)确定原溶液中有Al O2-。第(4)确定原溶液中有 、Mg2+、Al3+、Fe2+等离子。第(3)确定原溶液中有Al O2-。第(4)确定原溶液中有 ,则没有Ba2+。第(5)确定原溶液中有 ,则没有Ba2+。第(5)确定原溶液中有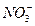 。 。
本题难度:一般
|