微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如果你家里的食用花生油不小心混入大量的水,你将采用下列何种方法分离( )
A.过滤
B.蒸馏
C.分液
D.萃取
2、选择题 欲除去物质中所含少许杂质,所用的方法错误的是( )
A.物质:O2,杂质:CO2、H2O,除去杂质所用方法:依次通过苛性钠溶液和浓H2SO4
B.物质:CO2,杂质:CO,除去杂质所用方法:通过灼热的铜网
C.物质:铜粉,杂质:铁粉,除去杂质所用方法:加适量盐酸,反应后再过滤
D.物质:火碱溶液,杂质:纯碱,除去杂质所用方法:加适量石灰水,滤去沉淀
3、填空题 碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:

(1)原料需要粉碎,其目的是????????????????????;滤渣I的主要成分是???????????????????;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入?????????????????????????试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为?????????????????????;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是?????????????;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是????;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为??????????;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为????????????????????????????????????????????。
4、计算题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)固体X中主要含有??????(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用??????(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是??????。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
?????????、过滤、???????、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是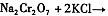
 。该反应在溶液中能发生的理由是:????????????????。
。该反应在溶液中能发生的理由是:????????????????。

(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量?????????(填写试剂)、溶解、过滤、再加入过量?????????????(填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为????????????(用含m、n的代数式表示)。
5、选择题 除杂的原则是不增(不加入新的物质)--不可“前门驱虎,后门进狼”、不减(不消耗被提纯物质)--不 可“玉石俱焚”、易分(杂质转换为沉淀、气体等易分离除去)--不可“难舍难分”。为了使杂质除尽和便 于操作,加入的试剂不能用“适量”而应“过量”。请你判断提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法应为 [???? ]
A.加入过量的碳酸钠溶液,过滤除去沉淀,滤液中补加适量硝酸
B.加入过量的硫酸钾溶液,过滤除去沉淀,滤液中补加适量硝酸
C.加入过量的碳酸钾溶液,过滤除去沉淀,滤液中补加适量盐酸
D.加入过量的碳酸钾溶液,过滤除去沉淀,滤液中补加适量硝酸