微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS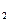 )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加H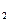 O
O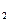 溶液需足量的理由是________________。
溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量
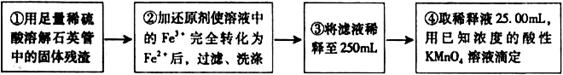
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
参考答案:(14分)
(1)氢氧化钠(或氢氧化钾等)(2分)
本题解析:略
本题难度:一般
2、选择题 下列描述中,符合化学科学的是[???? ]
A.“纯碱”就是碱
B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C.“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D.“曾青得铁则化为铜”中的“曾青”是指青铜
参考答案:B
本题解析:
本题难度:简单
3、填空题 (12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
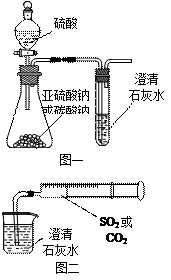
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
饱和石灰水与水的体积比
| 1:0
| 1:1
| 1:2
| 1:3
| 1:5
| 1:7
|
能生成CaCO3的最大量(g/100水)
| A
| 0.110
| 0.073
| 0.055
| 0.037
| 0.028
① 上表中A=???????????????????g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
热力学温度/K
| 282
| 298
| 308
| CaCO3溶解度(g/100水)
| 0.130
| 0.094
| 0.076 5
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
P(CO2)/Pa
| 0
| 1.40×104
| 9.95×104
| CaCO3溶解度(g/100水)
| 0.001 3
| 0.023 3
| 0.108 6
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:??????????????????????????????????????
??????????????????????????????????????????????????????????????????????????????????
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是: ???????????????????????????????????????????????????????????????????????????????????
参考答案:(1)两者反应时直接生成了酸式盐而看不到沉淀(2分)
本题解析:略
本题难度:简单
4、简答题 小明欲探究铁及其化合物的氧化性和还原性,请你帮他完成以下实验报告.
实验目的:探究铁及其化合物的氧化性和还原性
可供选用的试剂:铁粉、FeCl3、溶液、FeCl2溶液、氯水、锌片
实验记录:(请填写表中空白)
序号
实验操作
实验现象 | 离子方程式 | 实验结论
①
在FeCl2溶液中
加入锌片
溶液由浅绿色变为无色
Zn+Fe2+=Zn2++Fe
②
Fe2+具有还原性
③
在FeCl3溶液中加入足量铁粉
溶液由棕黄色变为浅绿色
Fe+2Fe3+=3Fe2+
Fe3+具有氧化性,Fe具有还原性
参考答案:①亚铁离子中的铁是+2价,当遇到强还原剂金属锌时,显示氧化性
本题解析:
本题难度:一般
5、实验题 某化学课 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
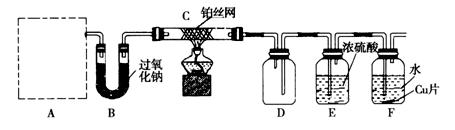
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4+ + OH– = NH3?H2O
C.可通过加热方法区别该试剂和(NH4)2SO4
D.工业上用NH3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
___________________________________________________________________ __。 __。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:_____________________________________________________________________________________ ____________________________________________________________。 ____________________________________________________________。
参考答案:(1) NH4HCO3(2分)??试管、酒精灯(2分)???
本题解析:略
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772